题目内容
【题目】某种金属混合物样品由镁、铁、锌三种金属中的两种金属组成,取5.6g样品与足量的稀盐酸反应,得到0.2 g氢气,则此样品的组成是()
A.镁和铁B.镁和锌C.铁和锌D.无法确定
【答案】B
【解析】
根据一定量金属与足量酸完全反应时, ![]() ,进行计算、分析,产生0.2g氢气,则消耗两种金属的质量一种大于5.6g,另一种小于5.6g。
,进行计算、分析,产生0.2g氢气,则消耗两种金属的质量一种大于5.6g,另一种小于5.6g。
设得到0.2g氢气需要消耗金属镁的质量为a,![]() ,a=2.4g<5.6g;
,a=2.4g<5.6g;
设得到0.2g氢气需要消耗金属铁的质量为b,![]() ,b=5.6g;
,b=5.6g;
设得到0.2g氢气需要消耗金属锌的质量为c,![]() ,c=6.5g>5.6g;
,c=6.5g>5.6g;
5.6g样品与足量的稀盐酸反应,得到0.2 g氢气,该金属样品是两种金属组成的混合物,故样品是镁和锌的混合物。故选B。

【题目】某小组在学习“二氧化碳与氢氧化钠溶液反应”时,进行了如下探究:
【提出问题】二氧化碳与氢氧化钠反应,还是溶解在水中?
【查阅资料】
①15℃、101KPa时,二氧化碳的溶解度如下:
溶剂 | 水 | 酒精 |
溶解度 | 1.0 | 0.5 |
②15℃时,在酒精中氢氧化钠易溶、碳酸钠微溶。
③通常情况下,稀溶液的体积约等于溶剂的体积。
【实验设计】在15℃、101KPa时,制取二氧化碳并用于实验甲、实验乙。

【分析与表达】
(1)如果二氧化碳与氢氧化钠反应,化学方程式是 ,那么氢氧化钠应 保存。
(2)实验前,两套装置都进行气密性检查,实验甲装置气密性检查的方法是
。
(3)实验甲中,同时滴入等体积的水和氢氧化钠溶液后的现象是 。
(4)实验乙中,将氢氧化钠完全滴入锥形瓶中,注射器会自动向内移动并将酒精推入锥形瓶,活塞的移动速度是 。(填答案字母)
A.先慢后快 B.先快后慢 C.先慢后快,再变慢
实验乙中,还可能观察到的现象是 。
(5)实验乙中,120mL酒精 (填“能”或“不能”)换成水,原因是 。
(6)实验乙结束时,注射器中酒精灯体积为20mL,则与氢氧化钠反应的二氧化碳体积至少是 mL。
(7)由以上探究可知,二氧化碳能溶于水,也能氢氧化钠反应,但实验乙的数据还不够准确,造成实验乙误差的原因可能有 。(写一条)
【题目】无论在化学世界里,还是在日常生活中,酸是广泛存在而又非常重要的物质。下面对常见的酸——硫酸的部分性 质进行探究。
(1)浓硫酸的特性
①向一个烧杯中加入一定质量的浓硫酸,总质量为m1;敞口放置在空气中一段时间后,总质量为m2,那么,m1_____m2(选填“>、=、<")。
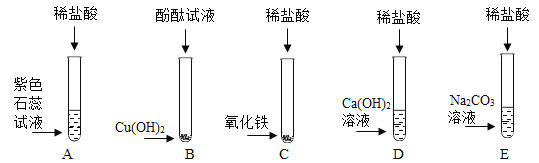
②如图所示,将水滴入装有浓硫酸的锥形瓶中(锥形瓶和木板用熔化的石蜡粘在一起),观察到液滴四溅。据此分析,下列关于浓硫酸的叙述正确的是____。
A.稀释浓硫酸时, 一定要将浓硫酸缓慢注入水中
B.稀释浓硫酸时,一定要 将水缓慢注入浓硫酸中
C.浓硫酸充分溶于水后,可以将锥形瓶从木板上轻轻提离
(2)与金属反应
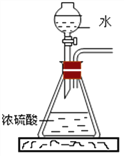
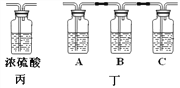
向装有镁、铁、铜的A、B、C三只试管中(如图),分别加入等质量等质量分数的稀硫酸,不能观察到明显现象的是______(填序号);请写出反应最剧烈的试管中发生反应的化学方程式___________。
(3)与非金属反应
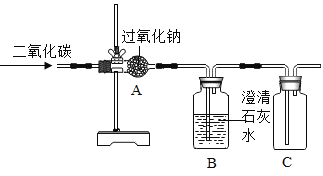
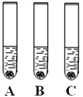
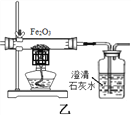
将冷的浓硫酸加入到装有碳粉的圆底烧瓶中,无明显现象;加热该混合物,有大量气泡产生,现对导出的气体成分进行验证。
(查阅资料)
①碳与浓硫酸在加热时,除了生成水之外,还生成二氧化碳和碳的一种氧化物;
②二氧化硫和二氧化碳都能使澄清石灰水变浑浊,其中二氧化硫还能使紫红色的酸性高锰酸钾溶液褪色。
(实验验证)某化学兴趣小组在老师指导下设计了如下实验装置进行验证。
温馨提示:丁装置的A、B、C中均装有紫红色的酸性高锰酸钾溶液
![]()
①为了完成对导出气体的验证,请将上述装置进行正确的连接:甲→______→______丙→_______(填序号)。
②请完成下表中的相关内容:
实验现象 | 实验结论 |
乙中观察到的现象_______ | 证明碳与浓硫酸加热反应生成碳的氧化物是二氧化碳而不是一氧化碳 |
丁装置A中溶液褪色 丁装置C中溶液不褪色 | 证明气体中有___________ 装置C的作用______________ |
戊中白色固体变蓝 | 证明气体中有水蒸气 |
(获得结论)碳与浓硫酸加热反应的化学方程式__________。
(知识拓展)化学反应的进行与反应物的溶质质量分数、反应条件都有一定关系。酸不仅仅能与某些金属反应,还能与某些非金属单质在一定条件下反应。