题目内容
据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜.
(1)请完成该反应的化学方程式:2Cu+2H2SO4+O2 2CuSO4+ 2H2O
2CuSO4+ 2H2O
(2)某同学想利用此反应,将80g含铜80%的废料转化为10%的硫酸铜溶液,计算需要加入10%的稀硫酸和水的质量(假设杂质不参加反应,也不溶于水).
(1)2H2O;(2)需要加入10%的稀硫酸和水的质量分别为980g、540g.
解析试题分析:(1)由质量守恒定律反应前后原子的种类和数目不变进行分析,反应前铜原子的数目是2个,氢原子的数目是4个,氧原子的数目是10个,硫原子的数目是2个,反应后铜原子的个数是2个,硫原子的个数是2个,氧原子的个数是8个,故确定生成物除硫酸铜外,另一种为水,应填2H2O;(2)设生成硫酸铜的质量为x,生成水的质量为y,参加反应的硫酸的质量为z
2Cu+2H2SO4 +O2 2CuSO4 +2H2O
2CuSO4 +2H2O
128 196 320 36
80g×80% z x y =
= z=98g
z=98g =
= x=160g
x=160g =
=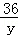 y=18g
y=18g
稀硫酸溶液的质量=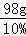 =980g
=980g
硫酸铜溶液的质量= =1600g
=1600g
则加入水的质量=1600g﹣﹣160g﹣18g﹣980g×90%=540g
答:需要加入10%的稀硫酸和水的质量分别为980g、540g.
考点:根据化学反应方程式的计算;质量守恒定律及其应用.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的文字表达式: _____________________
小倩发现,氯酸钾与氧化铁混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除二氧化锰、氧化铁外,氧化铜也可以作氯酸钾分解的催化剂.
【完成实验】按下表进行实验:测定分解温度(分解温度越低,催化效果越好).
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | 氯酸钾 | 580 |
| ② | 氯酸钾、二氧化锰(质量比1:1) | 350 |
| ③ | 氯酸钾、氧化铁(质量比l:1) | 390 |
| ④ | 氯酸钾、氧化铜(质量比1:1) | 370 |
【分析数据、得出结论】
(1)由实验 与实验④对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是________.
【反思】
(1)若要证明氧化铜是该反应的催化剂,还要验证它在化学反应前后质量和____不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证___________________________________________________;
浓硫酸是化学实验室的一种常用试剂,小王同学在实验室里观察到一瓶浓硫酸的标签,如下图
| 浓硫酸(500ml) 相对分子质量 98 溶质质量分数 98% 密度 1.84克/毫升 |
(1)小王在取用时不小心把浓硫酸滴在纸上,发现纸很快变黑炭化,这是发生了 变化。
(2)实验室经常需要把浓硫酸稀释成稀硫酸来使用,若浓硫酸和水的体积按1:4的比例稀释,所得稀硫酸的溶质质量分数是多少?
(3)实验后,小王没有把浓硫酸的瓶盖拧紧,久置后这瓶浓硫酸的溶质质量分数会变小,这是因为浓硫酸具有 。

