题目内容
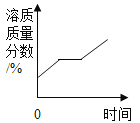
【题目】如图是a、b、c三种固体物质的溶解度曲线,回答下列问题:
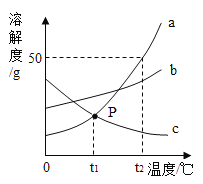
(1)t1℃,a的溶解度_____c的溶解度;(填“>”“=”“<”)
(2)若从b的溶液中得到的b的晶体用______结晶。
(3)t2℃时,将30ga物质放入50g水中充分溶解,所得溶液中溶质与溶剂质量比是___;
(4)保持t2℃不变,要使接近饱和的b溶液变为饱和溶液,你采取的方法是_____。
(5)现将t2℃时a、b、c三物质的饱和溶液降温到t1℃,所得溶液溶质质量分数大小关系为____。
【答案】= 蒸发结晶 1:2 增加溶质(或恒温蒸发溶剂) b>a>c
【解析】
由a、b、c三种固体物质的溶解度曲线图可知,a、b物质的溶解度随温度的升高而增大,a物质的溶解度受温度的影响较大,c物质的溶解度随温度的升高而减小。
(1) 由a、b、c三种固体物质的溶解度曲线图可知,t1℃,a、c两种物质的溶解度曲线相交,故a的溶解度=c的溶解度。
(2) 由溶解度曲线图可知,b物质的溶解度受温度的影响较小,故若从b的溶液中得到的b的晶体用蒸发结晶。
(3) t2℃时,a物质的溶解度为50g,50g水中最多溶解的a物质的质量为![]() ,将30ga物质放入50g水中充分溶解,最多溶解25g,则所得溶液中溶质质量为25g,溶剂质量为50g,故所得溶液中溶质与溶剂质量比是
,将30ga物质放入50g水中充分溶解,最多溶解25g,则所得溶液中溶质质量为25g,溶剂质量为50g,故所得溶液中溶质与溶剂质量比是![]() 。
。
(4) b物质的溶解度受温度的影响较小,保持t2℃不变,要使接近饱和的b溶液变为饱和溶液,采取的方法是增加溶质(或恒温蒸发溶剂)。
(5) a、b物质的溶解度随温度的升高而增大,a物质的溶解度受温度的影响较大,c物质的溶解度随温度的升高而减小,t2℃时,a、b、c三种物质的溶解度关系为a>b>c,t1℃时,a、b、c三种物质的溶解度关系为b>a=c,将t2℃时,a、b、c三种物质的饱和溶液降温到t1℃,a、b两种物质均有晶体析出,a物质析出晶体较多,降温后b的溶解度大于a,b溶液的溶质质量分数大于a溶液的溶质质量分数,c的溶液组成不变,溶质质量分数不变,故所得溶液溶质质量分数大小关系为b>a>c。

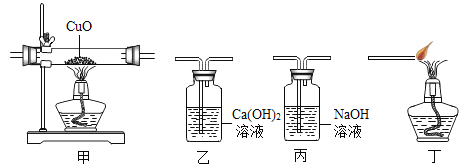
【题目】某小组用下图装置探究不同碱溶液吸收二氧化碳的效果。
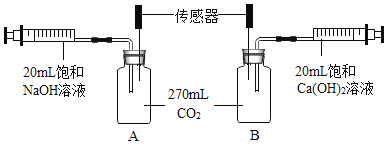
已知:①该实验中,270mL CO2的质量约为0.5 g;
②20℃时,物质的溶解度:NaOH 109g,Ca(OH)20.165g。
20℃时,分别将注射器中的液体全部快速推入集气瓶。B中集气瓶内溶液先变浑浊后变澄清,压强传感器测定数值如下:
推入液体后压强 | 最终压强 | |
A | 106 kPa | 6.2 kPa |
B | 106 kPa | 103.8 kPa |
(1)A中集气瓶内压强下降的原因是________(用化学方程式表示)。
(2)吸收CO2效果更好的是饱和________溶液(填“NaOH”或“Ca(OH)2”)。
(3)某同学推测,碳酸钙能与水和二氧化碳发生反应生成可溶性物质,依据的现象是________。
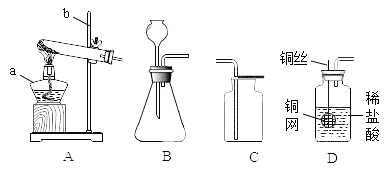
【题目】碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
[查阅资料]补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应,高温灼烧时会燃烧或分解。
[设计实验]根据资料和已学知识,该小组同学设计如下两种实验方案进行测定。
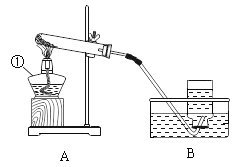
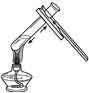
方案①:根据下图所示装置实验。
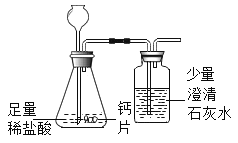
(1)锥形瓶中发生反应的化学方程式为___________________。
(2)长颈漏斗下端插入液面下的目的是___________________。
(3)记录数据如下:
钙片质量 | 空洗气瓶质量 | 澄清石灰水质量 | 反应后洗气瓶及瓶内物质总质量 |
25g | 100g | 50g | 150.4g |
方案②:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100g, 加入钙片质量为25g):
加入稀盐酸的总质量 | 100g | 200g | 300g | 400g |
充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
[分析评价]
方案①和方案②中合理是方案___________________,原因是___________________。
[得出结论]经过计算,该钙片中碳酸钙的质量分数是___________________。
[反思回顾]该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是___________________。