题目内容
【题目】浓硝酸是一种具有强氧化性的酸,可以和铜在常温条件下反应生成二氧化氮、硝酸铜及一种常温下呈液态的物质,该反应的化学方程式为_________;将ag铜和碳的混合物在氧气中充分灼烧、冷却、称量,发现剩余固体的质量仍为ag,该混合物中碳的质量分数为___________。
【答案】![]() 20%
20%
【解析】
(1)根据质量守恒定律化学反应前后元素的种类不变,可推出常温下呈液态的物质为H2O,故该反应的化学方程式为![]() 。
。
(2)将铜和碳的混合物在氧气中充分灼烧,碳和氧气反应生成了二氧化碳,固体质量减少(碳元素) ,铜和氧气反应生成了氧化铜,固体质量增加(氧元素)。由剩余固体(氧化铜)的质量与原混合物质量相同可知,与铜反应的氧气的质量等于混合物中碳的质量,该混合物中碳的质量分数就是氧化铜中氧元素的质量分数。氧化铜中氧元素的质量分数为![]() ,故混合物中碳的质量分数为20%。
,故混合物中碳的质量分数为20%。

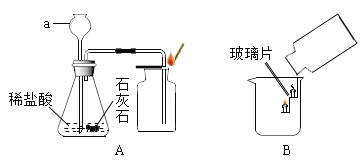
【题目】某化学兴趣小组根据图1所示进行模拟炼铁的实验,并对产物成分进行探究。
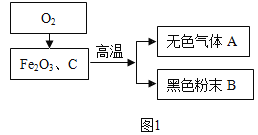
[初步实验结果]无色气体A不含有单质气体,黑色粉末B含有两种单质中的一种或者两种。
[猜想与假设]甲组同学认为无色气体A中可能有CO2和CO.乙组认为黑色粉末的成分中存在以下三种情况:
假设一:只含有铁。
假设二:只含有碳。
假设三:_________。
[实验与探究]
(1)为验证甲组的猜想,大家按图2进行实验:
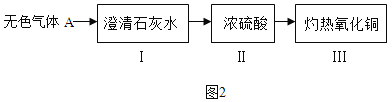
当看到实验I中__________,实验Ⅲ中__________等现象时,可以确定甲组同学猜想正确。
(2)为验证乙组中假设三能否成立,大家用物理和化学两种方法来进行探究。
实验方法 | 实验操作 | 实验现象 | 实验结果 |
物理方法 | 用磁铁靠近粉末 | ___________ | 假设三成立 |
化学方法 | 取少量黑色粉末B于试管中,加入过量的稀盐酸。 | ___________ | 假设三成立 |
写出黑色粉末B中加入过量的稀盐酸反应的化学方程式__________。
[交流与反思]在做图2所示的实验时发现其存在一个缺陷,请指出来:___________。
【题目】铝是大自然赐予人类的宝物,但人们对它的认识经历了较为漫长的过程。小红、小明对实验室的铝片性质进行探究。
(查阅资料)铝、氧化铝既能与酸反应,又可与强碱溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;氧化铝与氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和一种氧化物。NaAlO2易溶于水,其水溶液呈碱性,NaAlO2与铝、氧化铝均不反应。
实验一:
实验步骤 | 实验现象 | 解释 |
取少量氢氧化钠溶液于试管中, 向其中插入没有打磨的铝片 | 开始时无明显现象,后铝片逐渐溶解,____________ | 该实验中,开始时无明显现象的原因是____________ (用化学方程式表示) |
(拓展应用)有一种管道疏通剂,主要成分为铝粉和氢氧化钠粉末。工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对油脂和毛发等淤积物的腐蚀,同时产生氢气增加管道内气压,利于疏通。
实验二:小明用如图所示的玻璃弯管模拟家庭下水道,并用动物脂肪和毛发堵在弯管处,他按照使用说明从左端管口加入管道疏通剂,并用胶塞堵住弯管左端上口,可能出现的现象为____________ (填字母序号)。
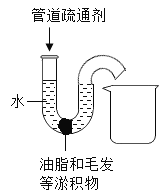
A 产生大量气体 B 弯管内温度升高 C 堵塞物变软被气体赶出,落入烧杯中
实验三:为了证明实验二烧杯中收集的废液里是否还含有氢氧化钠,小明做了如下实验:
实验操作 | 实验记录 | 实验结论 |
取少量澄清废液于试管中,用pH试纸测其酸碱度 | pH____________7(填>、<或=) | 废液中有氢氧化钠剩余 |
小红对小明的结论提出了质疑,理由是____________;小红把pH试纸改用____________ (填药品)进行实验,得出废液中还含有氢氧化钠。管道疏道剂中氢氧化钠过量,可确保铝粉反应完全,并且过量的氢氧化钠对下水道有清污的作用。