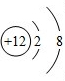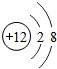题目内容
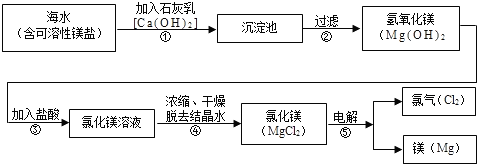
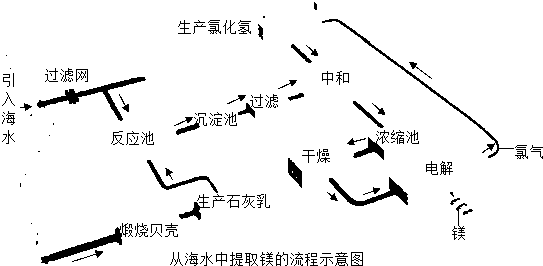
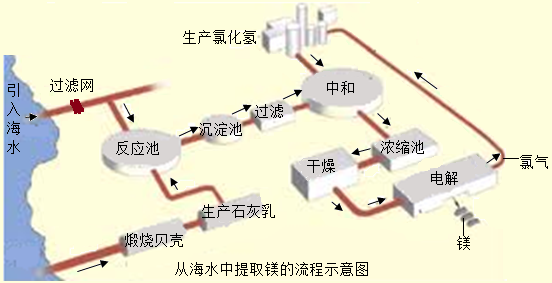
镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国际上的主要趋势,工业流程图如下;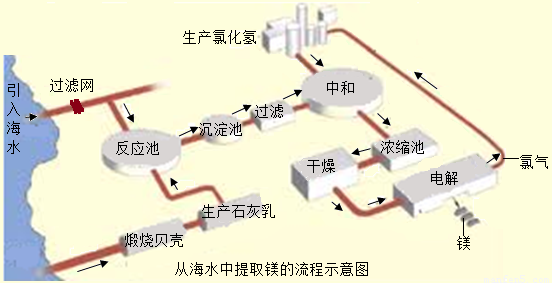
其步骤为:
Ⅰ.将海边大量存在的贝壳(主要成分为CaCO3)煅烧成生石灰,并将生石灰制成石灰乳
Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2?6H2O
Ⅳ.将MgCl2?6H2O在一定条件下加热得到无水MgCl2
V.电解熔融的无水MgCl2可得到Mg
(1)请根据上述步骤回答问题:
①写出步骤Ⅰ、Ⅲ的有关化学方程式:
Ⅰ.贝壳煅烧成生石灰______ CaO+CO2↑
【答案】分析:(1)根据反应物和生成物及其质量守恒定律可以书写化学方程式;根据化学方程式可以判断反应类型;在实验室中进行蒸发操作需要的主要仪器有蒸发皿、玻璃棒、酒精灯、带铁圈的铁架台、坩埚钳等;氯气可以用于生产氯化氢气体;
(2)带正电荷的离子属于阳离子;
(3)根据某些数据可以进行相关方面的计算.
解答:解:(1)①贝壳煅烧成生石灰的化学方程式为:CaCO3 CaO+CO2↑.
CaO+CO2↑.
Mg(OH)2沉淀中加入盐酸,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O.
②I中的碳酸钙反应属于分解反应,Ⅳ中的MgCl2?6H2O在一定条件下加热得到无水MgCl2属于分解反应,V中的电解氯化镁属于分解反应.故填:I、Ⅳ、V.
③在实验室中进行蒸发操作需要的主要仪器有蒸发皿、玻璃棒、酒精灯、带铁圈的铁架台、坩埚钳等.故填:蒸发皿、玻璃棒.
④电解产生的氯气用于生产氯化氢可以降低成本、减少污染.故填:电解产生的氯气用于生产氯化氢.
(2)①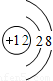 该图表示阳离子.故填:C.
该图表示阳离子.故填:C.
②镁原子在化学反应中容易失去电子,镁是一种活泼金属.故填:活泼.
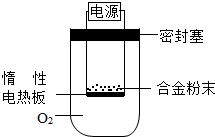
(3)①欲计算镁的质量分数,该实验中还需测定的一种数据是:完全反应后生成的固体的质量.故填:完全反应后生成的固体的质量.
因为镁除了能与氧气反应,还可以与氮气,二氧化碳等反应.故填:有.
②欲计算镁的质量分数,该实验中还需测定的一种数据是:充分反应后生成的氢气的质量.故填:充分反应后生成的氢气的质量.
点评:解答本题要掌握化学方程式的书写方法和反应类型的判断方法,能够通过相关数据进行有关方面的计算.
(2)带正电荷的离子属于阳离子;
(3)根据某些数据可以进行相关方面的计算.
解答:解:(1)①贝壳煅烧成生石灰的化学方程式为:CaCO3
 CaO+CO2↑.
CaO+CO2↑.Mg(OH)2沉淀中加入盐酸,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O.
②I中的碳酸钙反应属于分解反应,Ⅳ中的MgCl2?6H2O在一定条件下加热得到无水MgCl2属于分解反应,V中的电解氯化镁属于分解反应.故填:I、Ⅳ、V.
③在实验室中进行蒸发操作需要的主要仪器有蒸发皿、玻璃棒、酒精灯、带铁圈的铁架台、坩埚钳等.故填:蒸发皿、玻璃棒.
④电解产生的氯气用于生产氯化氢可以降低成本、减少污染.故填:电解产生的氯气用于生产氯化氢.
(2)①
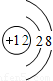 该图表示阳离子.故填:C.
该图表示阳离子.故填:C.②镁原子在化学反应中容易失去电子,镁是一种活泼金属.故填:活泼.
(3)①欲计算镁的质量分数,该实验中还需测定的一种数据是:完全反应后生成的固体的质量.故填:完全反应后生成的固体的质量.
因为镁除了能与氧气反应,还可以与氮气,二氧化碳等反应.故填:有.
②欲计算镁的质量分数,该实验中还需测定的一种数据是:充分反应后生成的氢气的质量.故填:充分反应后生成的氢气的质量.
点评:解答本题要掌握化学方程式的书写方法和反应类型的判断方法,能够通过相关数据进行有关方面的计算.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
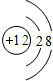 该图表示(填序号)
该图表示(填序号)