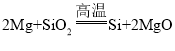题目内容
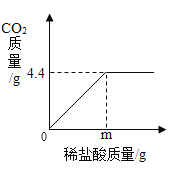
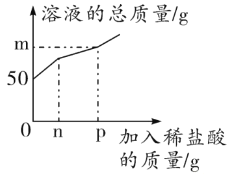
【题目】某兴趣小组的同学发现实验室中有一瓶敞口放置的氢氧化钠固体,他们十分好奇该瓶氢氧化钠是否变质,于是进行了如下实验操作。他们取一定量该氢氧化钠样品,向其中加入一定量水充分溶解得到50 g溶液,再向其中加入一定溶质质量分数的稀盐酸,测得产生气体的质量如下表所示。并对溶液的质量进行测定,绘制了如图所示的曲线。
加入稀盐酸的质量/g | 5 | 10 | 15 | 20 | 25 |
产生二氧化碳的质量/g | 0 | 0 | 0.22 | 0.44 | 0.44 |
试分析计算:
(1)曲线中m的值为______________________________;n的值为_________________________________。
(2)所用稀盐酸的溶质质量分数_____________。
(3)恰好完全反应时溶液中溶质的质量分数_____________。(计算结果精确到0.1% )
【答案】69.56 10 7.3% 3.4%
【解析】
根据题意,氢氧化钠固体变质是氢氧化钠与二氧化碳反应生成碳酸钠和水,向其中加入稀盐酸,氢氧化钠先与稀盐酸反应生成氯化钠和水,氢氧化钠反应完全后,碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳气体,由表格中数据可知加入10g稀盐酸时,未产生气体,加入15g稀盐酸生成0.22g气体,加入20g稀盐酸生成0.44g气体,即每加入5g稀盐酸生成0.22g二氧化碳,加入10g稀盐酸时,氢氧化钠恰好完全反应,加入20g稀盐酸时,碳酸钠恰好完全反应,结合上述数据绘制成溶液的质量与加入稀盐酸质量的变化曲线图,图中的n、p对应的拐点分别为氢氧化钠恰好反应的点和碳酸钠恰好反应的点,则有:
(1)曲线中m对应的溶液质量=50g+20g-0.44g=69.56g,即m的值为69.56;n的值为10。
(2)设5g稀盐酸中氯化氢的质量为x,则有:
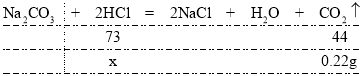
由![]() 解得x=0.365g
解得x=0.365g
稀盐酸的溶质质量分数为![]()
答:稀盐酸的溶质质量分数为7.3%。
(3) 恰好完全反应时溶液的总质量为69.56g,溶液中溶质为氯化钠,氯化钠中的氯元素全部来自于稀盐酸中的氯化氢,参加反应的氯化氢的质量为![]() ,
,
设氯化钠的质量为y,由氯元素守恒有![]()
解得y=2.34g
则溶液中溶质的质量分数为![]()
答:恰好完全反应时溶液的质量分数为3.4%。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】硝酸钾和氯化钠在不同温度下的溶解度如下表,请回答。
温度/℃ | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 硝酸钾 | 31.6 | 63.9 | 110 | 169 | 246 |
氯化钠 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
(1)60℃时硝酸钾的溶解度是_____g。
(2)若硝酸钾中混有少量的氯化钠,提纯硝酸钾可以采取的方法是_____。
(3)20℃时,将硝酸钾和氯化钠两种固体各36g分别加入盛有100水的烧杯中,充分溶解后可观察到如图所示的现象。
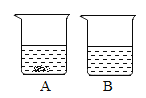
①烧杯A中溶解的物质是_____。
②若向烧杯A中加入一定量的水使剩余固体刚好全部溶解变为饱和溶液,则溶液中溶质的质量分数_____(填“变大”、“变小”或“不变”)。
③若将A、B烧杯中的物质同时升温至80℃,则A、B中溶质的质量_____(填“一定”或“不一定”)相等。