题目内容
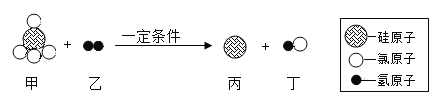
【题目】下图是一种制备高纯硅的工艺流程图。

(1)反应I的化学方程式: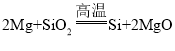 ,该反应所属的基本反应类型是_________反应;
,该反应所属的基本反应类型是_________反应;
(2)操作I的名称是①________;所得粗硅应充分洗涤,以除去表面可能含有的盐酸、②___________;
(3)上述已知生产流程中,可以循环利用的物质的化学式为_____________。
【答案】置换 过滤 MgCl2 HCl
【解析】
(1)根据反应I的化学方程式: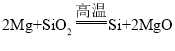 可知,该反应是单质和化合物反应生成单质和化合物的反应,属于置换反应;
可知,该反应是单质和化合物反应生成单质和化合物的反应,属于置换反应;
(2)过滤可以将不溶性固体从溶于中分离出来,所以操作1的名称是过滤,盐酸和氧化镁、镁反应会生成氯化镁,所以所得粗硅应充分洗涤,以除去表面可能含有的盐酸、MgCl2;
(3)既是反应物,也是生成物的物质可以循环使用,所以上述已知生产流程中,可以循环利用的物质的化学式为HCl。

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
【题目】某兴趣小组的同学发现实验室中有一瓶敞口放置的氢氧化钠固体,他们十分好奇该瓶氢氧化钠是否变质,于是进行了如下实验操作。他们取一定量该氢氧化钠样品,向其中加入一定量水充分溶解得到50 g溶液,再向其中加入一定溶质质量分数的稀盐酸,测得产生气体的质量如下表所示。并对溶液的质量进行测定,绘制了如图所示的曲线。
加入稀盐酸的质量/g | 5 | 10 | 15 | 20 | 25 |
产生二氧化碳的质量/g | 0 | 0 | 0.22 | 0.44 | 0.44 |
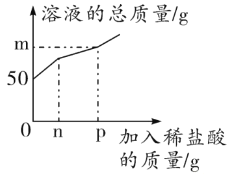
试分析计算:
(1)曲线中m的值为______________________________;n的值为_________________________________。
(2)所用稀盐酸的溶质质量分数_____________。
(3)恰好完全反应时溶液中溶质的质量分数_____________。(计算结果精确到0.1% )