题目内容
【题目】实验室以软锰矿(主要成分为MnO2 , 还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如图: 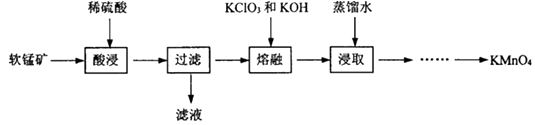
(1)“酸浸”目的是除去MnO2中的杂质,需要加热的目的是;此过程中发生的化学反应方程式是 . (任写一条)
(2)“熔融”过程中,MnO2被氧化成K2MnO4 , 同时得到KCl, ①该反应的化学方程式为 .
②加入KClO3应过量的原因除了提高MnO2利用率,还有 .
(3)浸取后为了得到较纯净的KMnO4晶体,通过蒸发浓缩、冷却结晶、过滤出KCl溶液,将晶体洗涤、低温烘干等一系列操作,其中采用低温烘干的原因是 , 写出“浸取”过程中,Cl2和K2MnO4的反应方程式 .
(4)在氧化、还原反应中,氧化剂的元素化合价降低,还原剂的元素化合价升高,以上流程中起到氧化作用的物质是 .
【答案】
(1)加快反应速率;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
(2)3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O;氯酸钾加热后会分解
3K2MnO4+KCl+3H2O;氯酸钾加热后会分解
(3)防止高锰酸钾分解;Cl2+K2MnO4=KMnO4+KCl
(4)氯酸钾和氯气
【解析】解:(1)“酸浸”目的是除去MnO2中的杂质,需要加热的目的是加快反应速率; 此过程中发生的反应有:稀硫酸和氧化亚铁反应生成硫酸亚铁和水,和氧化铁反应生成硫酸铁和水,和氧化镁反应生成硫酸镁和水,和氧化铝反应生成硫酸铝和水,反应的化学方程式为:FeO+H2SO4═FeSO4+H2O,Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,MgO+H2SO4═MgSO4+H2O,
Al2O3+3H2SO4═Al2(SO4)3+3H2O.
故填:加快反应速率;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.(2)①二氧化锰和氯酸钾、氢氧化钾反应生成锰酸钾、氯化钾和水,该反应的化学方程式为:3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O.
3K2MnO4+KCl+3H2O.
故填:3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O.②氯酸钾受热分解生成氯化钾和氧气,为了提高MnO2利用率,弥补由于氯酸钾分解而导致的氯酸钾不足,加入的KClO3应过量.
3K2MnO4+KCl+3H2O.②氯酸钾受热分解生成氯化钾和氧气,为了提高MnO2利用率,弥补由于氯酸钾分解而导致的氯酸钾不足,加入的KClO3应过量.
故填:氯酸钾加热后会分解.(3)其中采用低温烘干的原因是防止高锰酸钾分解;
写出“浸取”过程中,锰酸钾和氯气反应生成高锰酸钾和氯化钾,反应的化学方程式为:Cl2+K2MnO4=KMnO4+KCl.
故填:防止高锰酸钾分解;Cl2+K2MnO4=KMnO4+KCl.(4)以上流程中,氯酸钾中的氯元素反应后的化合价降低,氯气中氯元素反应后的化合价降低,在化学反应中起到氧化作用.
故填:氯酸钾和氯气.
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号.