题目内容
【题目】将 25.6 gNaCl 和 MgCl2 固体混合物完 全溶于水中配成溶液,再将 200 g 一定溶质质量 分数的 NaOH 溶液不断分次加入到该溶液中,充分反应后,测得的实验数据如下表。求:
实验次数 | 1 | 2 | 3 | 4 | 5 |
加入NaOH 溶液质量/ g | 40 | 80 | 120 | 160 | 200 |
共生成沉淀的质量/ g | 2.9 | m | 8.7 | 11.6 | 11.6 |
(1) m=_______。
(2) 实验 __________(填实验编号)中氯化镁完全反应。
(3) 固体混合物中氯化钠的质量分数。______(写出计算过程,结果精确到 0.1%)
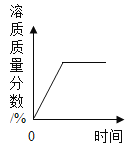
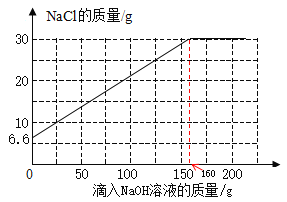
(4) 请在图中画出溶液中 NaCl 质量的变化曲线。_______
【答案】5.8 4 25.8% 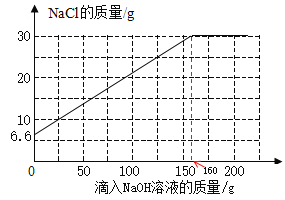
【解析】
(1)在化学反应中各物质之间的质量比是成正比例的,将 200 g 一定溶质质量分数的 NaOH 溶液不断分次加入到该溶液中,第1次产生沉淀的质量为2.9 g ,第3次还有沉淀产生,说明第2次加入的氢氧化钠溶液已完全反应,产生的沉淀质量与第1次沉淀质量相同,则m=2.9 g+2.9 g=5.8 g。
(2)第四次入氢氧化钠溶液后加产生的沉淀质量为11.6 g,第五次加入氢氧化钠溶液后加产生的沉淀质量还是11.6 g,说明第五次加入的氢氧化钠溶液没有参与反应,也就可以确定氯化镁在实验4已完全反应。
(3)解:设固体混合物中氯化镁的质量为X。
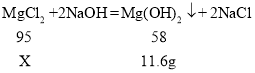
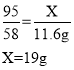
固体混合物中氯化钠的质量分数为:![]()
(4)将25.6 gNaCl 和 MgCl2 固体混合物完全溶于水中配成溶液,溶液中氯化钠的质量为25.6 g-19 g=6.6 g,也就是溶液中氯化钠的变化曲线起点坐标为(0,6.6);
设反应中生成氯化钠的质量为Y。
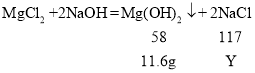
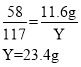
反应后溶液中氯化钠的质量为6.6 g+23.4 g=30 g
根据表格数据分析,第4次实验中产生的沉淀刚好是第1次产生的沉淀的4倍,且溶液中氯化镁的已完全反应,所以第4次实验刚好完全反应,消耗氢氧化钠溶液总质量为160 g,则溶液中氯化钠的变化曲线终点坐标为(160,30)
可以画出溶液中 NaCl 质量的变化曲线如图。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案