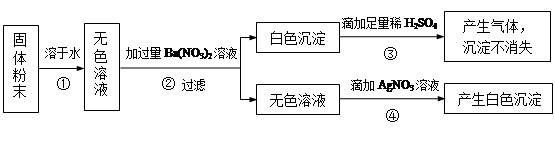��Ŀ����
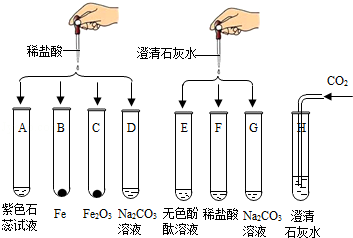
��֪NaOH����������е�CO2���ö����ʡ�С��ͬѧ��ʵ���ҷ���һƿ���ڷ��õ�NaOH�����,��Ʒ���,����ƿNaOH��������������������ʵ��̽��:
�ش���������:
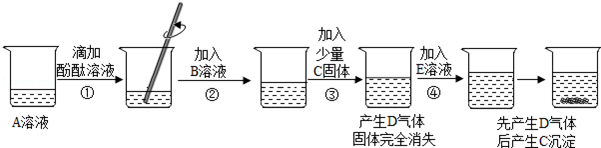
1)����ʵ����������Ʒֱ��Dz����������� ��,�������� ����
2)��������ʵ��,����ȷ���ù�������������(ѡ��ѡ���δ��)��
3)������мӹ����Ȼ�����Һ��Ŀ���� ��
4)�����E��pH=7,��A�ijɷ������� ��,
�����E��pH>7,��A�ijɷ������� ��
1���ܽ⣬���� 2���� 3��������Һ�е�̼���ƣ�Na2CO3��
4��̼���ƣ���Na2CO3���� ̼���ƺ��������ƣ���Na2CO3�� NaOH��
�������������1)�������������A�м�ˮ��ʹ���Ϊ��Һ������ӦΪ�ܽ⡣����,���ǽ�ԭ�������ʷֳɳ�������Һ�����֣���ӦΪ���ˡ�
2)�������ƹ��岻����ϡ���ᷴӦ�������壬Ҳ�������Ȼ�����Һ��Ӧ���ɳ����������ȷ������A�ѱ��ʡ���ɷֺ�̼���ơ��ݴ˿�֪������CΪ������̼���壬��Ӧ�۷����ķ�ӦΪ̼�������Ȼ��Ʒ�Ӧ����̼��Ƴ������Ȼ��ơ����Ժ�����DΪ̼��ơ�
3)��������ķ�����֪��A�ijɷ��к�̼���ƣ�����ȷ�������������ơ���������������ת����ҺE�С�Ȼ�������PHֵ��һ��ȷ����ɷ֡��������������Ƴʼ��������顣��̼���Ƶ�ˮ��ҺҲ�ʼ��ԣ������ڼ�����������֮ǰӦ��̼���ù������Ȼ���ȫ����ȥ��
4)����ȫ��ȥ̼����֮�������E��pH=7,����Һ�����ԣ�˵��ԭ�����в����������ơ���A�ijɷ�Ϊ��̼���ơ������E��pH>7,����Һ�ʼ��ԡ���ԭ�����к��������ƣ���A�ijɷ�Ϊ��̼���ƺ��������ơ�
���㣺���ʵ��ƶ�

 53���ò�ϵ�д�
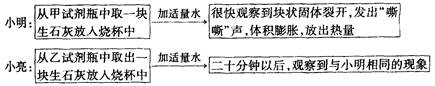
53���ò�ϵ�д�һͬѧ��ij�ִ��ν����ᴿʵ�飬�������ͼ��
��ش�
��1������ٺ͢ڵIJ��������� ��
��2��������жϼ������ᡰ�������ķ����� ������ܼ�������ʱҪ�ò��������Ͻ��裬����Ϊ�˷�ֹ �������������н϶����������ʱ��Ӧ ��������ʹˮ�����ɡ�
��3���������֤��
| ���� | ��֤�ķ��� | ���� | ���� |
| �������A�к�CaCO3��MgCO3 | ȡ��������A���Թ��У��μ�ϡ���ᣬ����Ϳ�г���ʯ��ˮ��С�ձ������Թܿ� | | �������� |
| �������A�к�BaCO3 | ȡ��������A���Թ��У��ȵ��� ���ٵ���Na2SO4��Һ | �����ݷų����ް�ɫ���� | |
| ���������Ƶõ�NaCl�����л�����Na2SO4 | ȡ����NaCl���������Թ��е�����ˮ�� | | �������� |


 �ش��������⣺
�ش��������⣺