题目内容
【题目】长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.为了测定水垢中碳酸钙的含量,将足量质量分数为10.0%的盐酸加入到10.0g水垢中,产生CO2气体的情况如图所示.
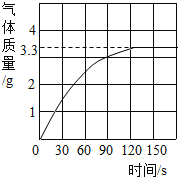
(1)水垢中碳酸钙的质量分数是多少?
(2)假设水垢中除碳酸钙和氢氧化镁外,不含其它杂质,溶解10.0g水垢,至少需要质量分数为10.0%的盐酸的质量是多少?(结果保留一位小数)
(3)若配制113.0g 10.0%的稀盐酸,需用38%的浓盐酸(密度为1.19g/cm3)的体积是多少毫升?(结果精确到个位)
【答案】(1)75%;(2)86.2g;(3)25mL
【解析】
解:(1)根据产生CO2气体的情况图,可得知碳酸钙完全反应时放出二氧化碳3.3g;设水垢中碳酸钙的质量为x,消耗HCl的质量为y.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 3.3g
![]() =
=![]() =
=![]()
解得:x=7.5g y=5.475g
水垢中碳酸钙的质量分数=![]() ×100%=75%
×100%=75%
答:水垢中碳酸钙的质量分数是75%;
(2)设氢氧化镁完全反应消耗HCl的质量为z
2HCl+Mg(OH)2═MgCl2+2H2O
73 58
z 10g﹣7.5g=2.5g
![]() =
=![]()
解得:z≈3.147g
至少需要质量分数为10%的盐酸的质量=![]() =86.2g
=86.2g
故答案为:86.2g
(3)设需用38%的浓盐酸的体积为V
113.0g×10.0%=38%×1.19g/mL×V
V=25mL
故答案为:25mL

练习册系列答案
相关题目
