题目内容
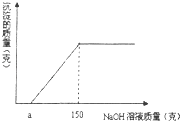
【题目】现有8g Fe2O3和CuO的混合物,进行如下实验:把混合物全部加入到50克足量的硫酸溶液中,完全溶解后,滴加溶质质量分数为8%的氢氧化钠溶液,滴加氢氧化钠溶液的质量与生成沉淀质量的关系如图所示.回答下列问题:
(1)求所用硫酸溶液溶质的质量分数.
(2)求 a的取值范围.
(3)若a=30,则将此16克混合物用过量的一氧化碳充分还原,求冷却后所得固体的质量.
【答案】(1)29.4%;(2)0<a<50;(3)12.16g.
【解析】(1)设硫酸的质量分数为x
2NaOH﹣﹣﹣Na2SO4﹣﹣﹣H2SO4
80 98
150g×8% 50g×x
![]() =
=![]()
x=29.4%;
(2)若8克固体全部为Fe2O3,则将铁元素全部转化为沉淀所需氢氧化钠溶液的质量为(y1)
Fe2O3﹣﹣2Fe(OH)3﹣﹣6NaOH
160 240
8g y1×8%
![]() =
=![]()
y1=150g
所以a=0
同理可得,当8克固体全部为CuO时,y2=100g
所以a=50
所以a的取值范围:0<a<50;
(3)若a=30,则与氢氧化钠反应的硫酸溶液量为
2NaOH﹣﹣﹣﹣﹣H2SO4
80 98
30g×8% y3×29.4%
![]() =
=![]()
y3=10g
则溶解氧化物固体的硫酸量为(50﹣10)×29.4%,
这些硫酸能夺取的氧元素为16×40×29.4%÷98=1.92g
剩余固体的量为(8﹣1.92)×2=12.16g.

练习册系列答案
相关题目