题目内容
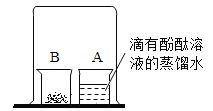
【题目】小文在整理实验室的时候,发现废液缸中液体颜色呈蓝色,缸底有固体。小文想探究废液缸中有些什么物质,老师告诉他废液缸中的物质是一个还原反应和一个中和反应的残留物,于是小文做了如下探究:
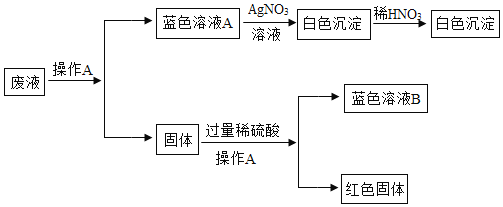
请回答:
(1)操作A是______,“蓝色溶液B”的溶质是______。
(2)“蓝色溶液A”与硝酸银溶液反应的化学方程式为______。
(3)废液缸中一定含有的物质为______。
(4)若“蓝色溶液A”只含一种溶质,则原“中和反应”的化学方程式为______,原“还原反应”的方程式为______ ![]() 写一个即可
写一个即可![]() 。
。
【答案】过滤 硫酸铜、硫酸 ![]() 铜、氧化铜、氯化铜
铜、氧化铜、氯化铜 ![]()
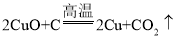
【解析】
废液经过操作A得到蓝色溶液A和固体,故操作A 是过滤,蓝色溶液A含铜盐溶液,向蓝色溶液A中加入硝酸银溶液,产生白色沉淀,且加稀硝酸不溶解,银离子能与氯离子结合生成氯化银白色沉淀,故蓝色溶液A中含氯化铜溶液;向固体中加入过量稀硫酸,得到蓝色溶液B和红色固体,红色固体应是铜,氧化铜能与稀硫酸反应生成硫酸铜和水,稀硫酸过量,故蓝色溶液B为硫酸铜和稀硫酸,过滤后得到的固体应为氧化铜和铜。
(1)操作A实现了固液分离,故操作A是过滤;
由分析可知,“蓝色溶液B”的溶质是硫酸铜和过量的硫酸。
故填:过滤;硫酸铜、硫酸。
(2)由分析可知,蓝色溶液A中含氯化铜溶液, 氯化铜与硝酸银反应生成氯化银沉淀和硝酸铜,该反应的化学方程式为:![]() ;
;
故填:![]() 。
。
(3)固体中加入稀硫酸后形成蓝色溶液和红色固体,说明稀硫酸和氧化铜反应生成了硫酸铜和水,不能和稀硫酸反应的铜形成红色固体,蓝色溶液A中含氯化铜溶液,故废液缸中一定含有的物质为铜、氧化铜、氯化铜。
故填:铜、氧化铜、氯化铜。
(4)若“蓝色溶液A”只含一种溶质,由以上分析可知,该溶质为氯化铜,则原“中和反应”是氢氧化铜和盐酸反应生成水和氯化铜,反应的化学方程式为:![]() ;
;
原还原反应可以是高温条件下氧化铜和碳反应生成铜和二氧化碳,反应的化学方程式: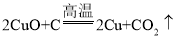 。
。

【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验图1
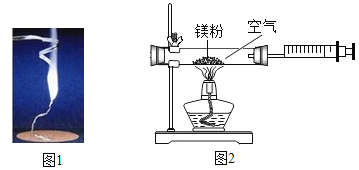
(1)小明认为根据质量守恒定律,燃烧产物的质量应大于反应物镁条的质量.待镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条的质量小,出现此现象的原因是_______________。
小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
[提出问题]黄色固体是什么呢?
[查阅资料]①氧化镁为白色固体,难溶于水且不与水反应;
②镁能与氮气反应只生成黄色的氮化镁(Mg3N2) 固体;
③氮化镁可与水反应,反应的化学方程式为![]()
④氢氧化镁是不溶于水的固体,且受热易分解生成氧化镁和水
[做出猜想]黄色固体为Mg3N2
[实验探究]
实验操作 | 实验现象及结论 |
如图,取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B
| (2)现象:________________ 结论:燃烧产物含Mg3N2 |
[拓展延伸]
(3)如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数_______1/5 (填“大于”、“小于”或“等于”)
(4)请选择下列正确的实验方案将混在氧化镁中的氮化镁除去____________
A将混合物直接蒸馏
B将混合物直接过滤
C将混合物溶于水,待充分反应后过滤,再将滤渣在常温下干燥.
D将混合物溶于水,待充分反应后过滤,再将滤渣充分加热至固体质量不再变化
(5)将足量的镁条放在含氮气和氧气质量比为7: 2的混合气体中充分燃烧反应,再将生成的固体物质与足量水反应产生气体质量为34g,求消耗镁条的质量为______________
【题目】实验是科学探究的重要方法。如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题。
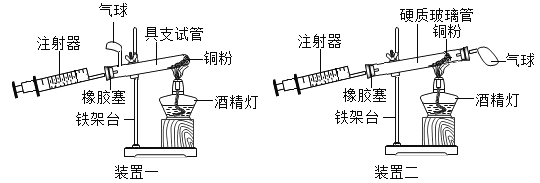
(1)在装置二中,根据下表提供的实验数据,完成下表。
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
20mL | 10 mL | 5 mL | ____ |
(2)装置一和装置二中气球的位置不同,________(填“装置一”或“装置二”)更合理,理由是________ 。
(3)若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举两条)________;________。
(4)加热时,硬质玻璃管里发生反应的现象________,反应的文字表达式为________,该反应的基本类型是________。