题目内容
【题目】下列选项中方程式和分析均完全正确的是
选项 | 化学方程式 | 分析 |
A. | S+O2 | 该反应的现象是产生二氧化硫气体 |
B. | Mg + O2==2MgO | 该反应可以在常温下进行,说明镁的化学性质比较活泼 |
C. | 2H2O2 | 该反应可以用于氢气的制取 |
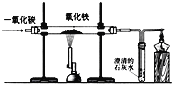
D. | Fe2O3+3CO | 该反应可用于提取铁矿石中的铁 |
A. A B. B C. C D. D
【答案】D
【解析】
A. S+O2![]() SO2 ,该反应的现象是产生无色有刺激性气味的气体,选项错误,
SO2 ,该反应的现象是产生无色有刺激性气味的气体,选项错误,
B. 2Mg + O2==2MgO,该反应可以在点燃下进行,说明镁的化学性质比较活泼,选项错误;
C. 2H2O2 ![]() 2H2O +O2↑, 该反应可以用于氧气的制取,选项错误;
2H2O +O2↑, 该反应可以用于氧气的制取,选项错误;
D. Fe2O3+3CO![]() 2Fe+3CO2, 该反应可以将铁由化合物还原成单质,可用于提取铁矿石中的铁,选项正确,故选D。
2Fe+3CO2, 该反应可以将铁由化合物还原成单质,可用于提取铁矿石中的铁,选项正确,故选D。

【题目】化学兴趣小组做酸和碱的中和反应时,往NaOH溶液中滴入几滴酚酞溶液,发现溶液刚变
红瞬间又褪成无色。讨论并猜想。
猜想一:可能是酚酞溶液变质
猜想二:可能与NaOH溶液的浓度有关
猜想三:可能是酚酞溶液在滴入过程中被O2氧化
……
(1)甲同学认为猜想一是不对的。其理由是_________________________。
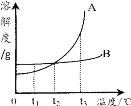
(2)取3mL不同浓度的NaOH溶液,分别滴入3滴酚酞溶液,观察现象。得到NaOH溶液的浓度与酚酞溶液褪色时间关系如图2所示。
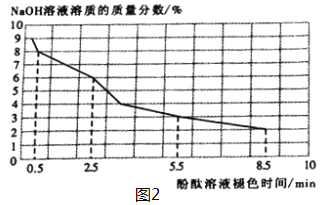
①根据图2所示,NaOH溶液溶质的质量分数________,酚酞溶液由红色褪为无色的时间越短。
②做酸和碱的中和反应时,滴加酚酞溶液的目的是________________________________。若用做实验的NaOH溶液溶质的质量分数为4%,完成该实验的操作时间应控制在_______之内。
(3)请设计实验,验证猜想三是否正确。
实验操作 | 实验现象 | 实验结论 |
__________ | 5.5min酚酞溶液褪色 | 酚酞溶液先变红后褪色与O2_______ (选填“有关”或“无关”) |
(4)探究酸碱中和反应时,逐滴加入稀盐酸的过程,并不断搅拌的目是_________________,写出该反应的化学方程式___________________________。