��Ŀ����
��6�֣��ش��������⣺
��Ӧ�ý������˳���ܰ������ǽ�һ��ѧϰ�������ʡ���֪���и������ʼ���ܷ����û���Ӧ��
A��Fe ��CuSO4��Һ B��Mg��MnSO4��Һ C��Mn��FeSO4��Һ
��д��Fe ��CuSO4��Һ��Ӧ�Ļ�ѧ����ʽ ��
������ͬ�����£����ֽ������������ᷴӦ������ҵ��� ��
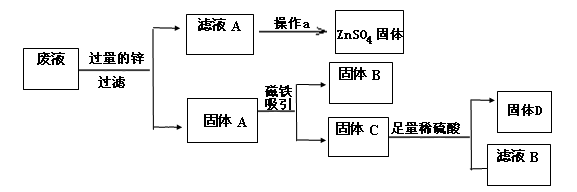
���Ȼ����ܸ�ʴͭ����ҵ�ϳ��ô�ԭ������ӡˢ��·�塣ӡˢ��·�����������Һ�Ĵ����������£�
�ٲ�����з�����������Ӧ��Fe + 2FeCl3 = 3FeCl2��Fe + CuCl2 = FeCl2 + Cu�������ijɷ��� ����Һ�е������� ��
�ڲ�����з�����Ӧ�Ļ�ѧ����ʽΪ ��
���Ȼ����ܸ�ʴͭ��ԭ���ǣ��û�ѧ����ʽ��ʾ�� ��
��Ӧ�ý������˳���ܰ������ǽ�һ��ѧϰ�������ʡ���֪���и������ʼ���ܷ����û���Ӧ��
A��Fe ��CuSO4��Һ B��Mg��MnSO4��Һ C��Mn��FeSO4��Һ
��д��Fe ��CuSO4��Һ��Ӧ�Ļ�ѧ����ʽ ��
������ͬ�����£����ֽ������������ᷴӦ������ҵ��� ��
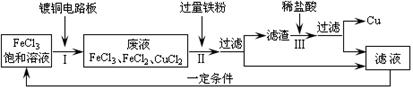
���Ȼ����ܸ�ʴͭ����ҵ�ϳ��ô�ԭ������ӡˢ��·�塣ӡˢ��·�����������Һ�Ĵ����������£�

�ٲ�����з�����������Ӧ��Fe + 2FeCl3 = 3FeCl2��Fe + CuCl2 = FeCl2 + Cu�������ijɷ��� ����Һ�е������� ��
�ڲ�����з�����Ӧ�Ļ�ѧ����ʽΪ ��
���Ȼ����ܸ�ʴͭ��ԭ���ǣ��û�ѧ����ʽ��ʾ�� ��
�� �� Fe + CuSO4 FeSO4 + Cu �� Mg
�� �� Fe��Cu FeCl2
�� Fe + 2HCl FeCl2 + H2��
�� Cu + 2FeCl3 2FeCl2 + CuCl2
�� �� Fe��Cu FeCl2
�� Fe + 2HCl FeCl2 + H2��
�� Cu + 2FeCl3 2FeCl2 + CuCl2
�����������1�������Ļ�Ա�ͭǿ����������ͭ��Һ��Ӧ����ͭ�������������ʻ�ѧ����ʽΪFe+CuSO4�TFeSO4+Cu��
����Fe�ܺ�CuSO4��Һ��Ӧ��������ͭǿ����Mg�ܺ�MnSO4��Һ��Ӧ����þ����ǿ����Mn��FeSO4��Һ��Ӧ�����̱���ǿ�������ֽ��������ǿ������˳��Mg��Mn��Fe��Cu�������ֽ������������ᷴӦ������ҵĽ���ΪMg��
��2������FeCl3��FeCl2��CuCl2�Ļ����Һ�м���������ۣ�������FeCl3��Ӧ����FeCl2����CuCl2��Ӧ����Cu��FeCl2����˿�֪�������������к���ʣ���Fe�����ɵ�Cu����Һ�к�FeCl2��
������Fe��Cu�������м���ϡ���ᣬ�������ᷴӦ����FeCl2��H2���ʷ�Ӧ�Ļ�ѧ����ʽΪFe+2HCl�TFeCl2+H2����
��ӡˢ��·������������÷�Һ�к�FeCl3��FeCl2��CuCl2�����ƶ��Ȼ����ܸ�ʴͭ����FeCl2��CuCl2���ʷ�Ӧ�Ļ�ѧ����ʽΪCu+2FeCl3 2FeCl2+CuCl2��
��������ǽ������˳����Ӧ�ã��ڽ������˳���У�λ����֮ǰ�Ľ����ܴ������û����⣬���ǿ�Ľ����ܽ�������Ľ�����������Һ���û�������

��ϰ��ϵ�д�
 ÿ�α���ϵ�д�
ÿ�α���ϵ�д�
�����Ŀ