题目内容
【题目】目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。可以说镍行业发展蕴藏着巨大的潜力。
Ⅰ制备草酸镍
工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍(NiC2O4)。
根据下列工艺流程图回答问题:
【资料卡片1】
(1)过氧化氢(H2O2)俗称双氧水,是一种液体,受热易分解,可用于实验室制取氧气;过氧化氢具有强氧化性,所以常作为氧化剂、漂白剂和消毒剂。
(2)氧化反应可以从元素化合价升降的角度进行分析:物质所含元素化合价升高的反应就是氧化反应。
(3)金属镍的化学性质类似于铁,与盐酸反应能生成氯化镍(NiCl2)。
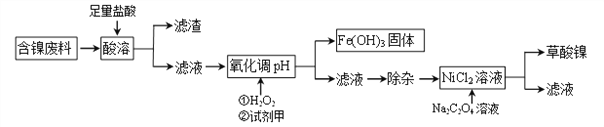
(1)“酸溶”之后的滤渣中含有的金属是_______________。
(2)写出酸溶过程中Ni与盐酸反应的化学方程式_________________________。
(3)加H2O2时,温度不能太高,其原因是_______________________。若H2O2在“酸溶”步骤即与盐酸同时加入,则与原方案相比滤液中会增加的金属离子是Cu2+和_______(写离子符号)。
(4)已知Na2C2O4溶液加入NiCl2溶液发生复分解反应,写出该反应的化学方程式____________。
Ⅱ制备镍粉
工业用电解镍液(主要含NiSO4)制备碱式碳酸镍晶体xNiCO3yNi(OH)2zH2O,并利用其制备镍粉,过程如下:
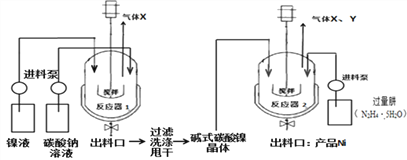
(5)反应器1中的一个重要反应为3NiSO4+3Na2CO3+2H2O ![]() NiCO32Ni(OH)2+3Na2SO4+2X,X的化学式为_________。
NiCO32Ni(OH)2+3Na2SO4+2X,X的化学式为_________。
(6)反应器1的出料口获得的固体洗涤时,需用纯水洗涤,可以用来检验固体已洗涤干净的试剂是____________。
(7)反应器2中产生的气体Y是空气中含量最多的气体,该气体是_________(填名称)。
Ⅲ 测定碱式碳酸镍晶体的组成
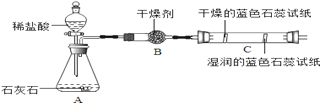
为测定碱式碳酸镍晶体【xNiCO3yNi(OH)2zH2O】组成,某小组设计了如下实验方案及装置:
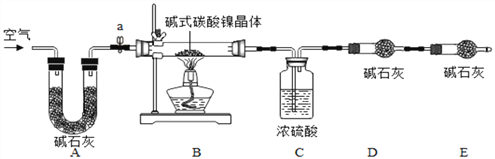
【资料卡片2】
(1)碱式碳酸镍晶体受热会完全分解生成NiO、CO2及H2O
(2)在温度控制不当导致温度过高时,NiO会被氧化成Ni2O3
(3)碱石灰是NaOH及CaO的混合物,可以吸收CO2和H2O
【实验步骤】
①检查装置气密性;②准确称取3.77g碱式碳酸镍晶体【xNiCO3yNi(OH)2zH2O】放在B装置中,连接仪器;③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量;④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤打开弹簧夹a,缓缓鼓入一段时间空气;⑥分别准确称量装置C、D、E的质量;⑦根据数据进行计算(相关数据如下表)。
装置C/g | 装置D/g | 装置E/g | |
加热前 | 200.00 | 180.00 | 180.00 |
加热后 | 201.08 | 180.44 | 180.00 |
【实验分析及数据处理】
(9)计算3.77g碱式碳酸镍晶体【xNiCO3yNi(OH)2zH2O】中镍元素的质量_________(写出计算过程,计算结果准确到小数点后两位)。
【实验反思】
(10)另一小组同学在实验中发现,实验结束后,称得装置B中残留固体质量明显偏大,老师带领全组同学经过仔细分析后发现,这是由于该组同学加热时在酒精灯上加了铁丝网罩,温度过高所导致。请问该组同学称得的残留固体中镍元素的质量分数可能是__________。
A.70.08% B.75.88% C.78.67% D.79.58%
【答案】 铜(Cu) Ni+2HCl=NiCl2+H2↑ 防止过氧化氢受热分解 Fe3+ Na2C2O4+ NiCl2=NiC2O4+ 2NaCl CO2 BaCl2(合理即可) 氮气 将装置内水蒸气和二氧化碳完全排除,被装置C、D充分吸收 3.77g-1.08g-0.44g=2.25g 2.25g×![]() ×100%=1.77g B
×100%=1.77g B
【解析】(1)镍合金废料中还含有Fe、Cu、Ca、Mg、C等杂质,“酸溶”之后可得氯化镍,所以滤渣中含有的金属是不与盐酸反应的铜;
(2)镍和盐酸反应生成氯化镍和氢气,化学方程式为:Ni+2HCl=NiCl2+H2↑;
(3)由资料可知,过氧化氢(H2O2)俗称双氧水,是一种液体,受热易分解,所以加H2O2时,温度不能太高,防止过氧化氢受热分解;过氧化氢具有强氧化性,若H2O2在“酸溶”步骤即与盐酸同时加入,则将铜氧化同时生成Cu2+,将铁氧化生成Fe3+;
(4)Na2C2O4溶液加入NiCl2溶液发生复分解反应,交换成分生成NaCl和NiC2O4,化学方程式为:Na2C2O4+ NiCl2=NiC2O4+ 2NaCl;
(5)反应器中的一个重要反应为3NiSO4+3Na2CO3+2H2O=NiCO32Ni(OH)2+3Na2SO4+2X,反应前Ni原子共3个、S原子共3个、O原子共23个、Na原子6个、C原子3个、H原子4个,反应后现有:Ni原子3个、S原子共3个、O原子共19个、Na原子6个、C原子1个、H原子4个,少O原子4个,C原子2个,而这些微粒包含在2个X分子中,所以X的化学式为 CO2;
(6)固体洗涤时,需用纯水洗涤,洗涤只要是除去表面附着的硫酸钠的,所以检验是否洗涤干净就是检验是否留硫酸根离子的残留,用含钡离子的可溶性溶液即可,可以是钡盐也可以是钡碱;
(7)气体Y是空气中含量最多的气体,空气中氮气占体积的大约五分之四,所以是氮气;
(8)反应后鼓入空气的目的是为了将装置B中的CO2和水蒸气完全排出,被装置C、D充分吸收,使计算结果更准确;
(9)碱式碳酸镍晶体受热会完全分解生成NiO、CO2及H2O,由题意可知,装置C 增加的质量为B中生成水的质量,即201.08g-200.00g=1.08g,装置D增加的质量为B中生成二氧化碳的质量,即180.44g-180.00g=0.44g ,所以反应后生成氧化镍的质量为3.77g-1.08g-0.44g=2.25g ,由质量守恒定律可知,故碱式碳酸镍晶体中镍元素的质量2.25g×![]() ×100%=1.77g;
×100%=1.77g;
(10)在温度控制不当导致温度过高时,NiO会被氧化成Ni2O3,所以当产物为全部为NiO时,残留固体中镍元素的质量分数为![]() ×100%≈78.67%,所以当产物为全部为Ni2O3时,残留固体中镍元素的质量分数为
×100%≈78.67%,所以当产物为全部为Ni2O3时,残留固体中镍元素的质量分数为![]() ×100%≈71.08%,所以残留固体中镍元素的质量分数在71.08%~78.67%之间。故填B。
×100%≈71.08%,所以残留固体中镍元素的质量分数在71.08%~78.67%之间。故填B。

 应用题作业本系列答案
应用题作业本系列答案【题目】通过对化学学习,相信你已经初步掌握了实验室制取气体的有关知识.请结合图示回答: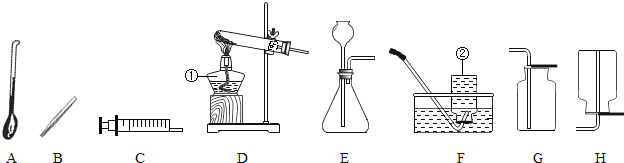
(1)写出图中标示的仪器名称:①___;②___
(2)甲KMnO4制取O2,应选用的发生装置为___(填字母序号,下同),收集装置可选用___(写一种即可);取用KMnO4为___色;写出该反应的化学方程式___.
(3)若用G装置收集氧气,检验氧气是否集满的方法是_____________________
(4)若乙同学用双氧水和二氧化锰来制取氧气,实验前为了控制反应速率,可选用___代替发生装置中某一仪器达到了实验目的实验结束后,乙同学想回收二氧化锰,可用___ (填实验操作名称)的方法分离出二氧化锰。该操作过程中需要用到的玻璃仪器主要有玻璃棒、烧杯和___,其中玻璃棒的作用是___.
(5)若收集气体丙时只能用装置G,则可推知气体丙的性质可能有___.
(6)化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验。
三个小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末。
A组:探究催化剂对化学反应速率的影响
取5mL10%H2O2溶液,三次实验分别加入0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
试剂 | MnO2 | 红砖粉末 | CuO |
t/s | 10 | 60 | 20 |
由此可出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用,某同学对该结论提出疑问。
补充对比实验,操作为___.
结果:长时间(大于100s),收集到很少量气体。
更正结论:红砖粉末___(选填“有”、“无”)催化作用,三者中___催化效率最高。
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t1.
乙同学:取10mL2.5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t2.
实验结果___.
结论:浓度越大,反应速率越快。
丙同学:对实验设计提出疑问,并补充实验___.
记录时间t3,且t1
更正结论为:当___时,反应物浓度越大,反应速率越快。
【题目】实验设计是化学实验的重要环节。请根据下列实验要求回答相关问题:
(1)【活动与探究一】用对比实验方法探究二氧化碳的性质。
实验一 | 实验二 |
|
|
①实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度由大到小顺序为___________,B瓶内变浑浊的化学方程式为________________________。
②实验二观察到C装置中发生的现象是____________、 ________ , 结论是________________ (用化学方程式表示)。
(2)【活动与探究二】定量测定空气中氧气的含量。
实验三 | |
|
|
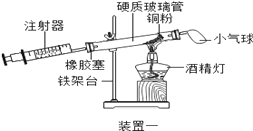
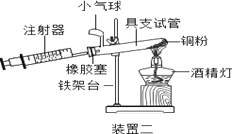
①实验三中,反应的原理为__________________ (用化学方程式表示);
②装置一比装置二更合理,理由是__________。
根据下表提供的实验数据,完成下表:
硬质玻璃管中空气体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气体积分数 |
30mL | 20mL | 10mL | ③_________ |
④定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果________ (填“偏小”、“偏大”或“无影响”)。