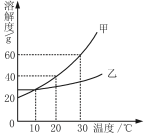
题目内容
【题目】我国化学家侯德榜(如图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
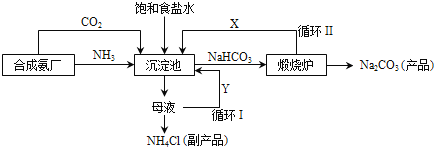

(1)上述生产纯碱的方法称________,副产品的一种用途为_______。
(2)向沉淀池中通入两种气体,先通入的是___________(填“NH3”或“CO2”),沉淀池发生的化学反应方程式是_______________。
(3)写出上述流程中X物质的化学式________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了_____(填“循环I”或“循环II”)。从沉淀池中取出NaHCO3沉淀的操作是_______。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,先滴加足量的_____,排除Na2CO3的干扰,再滴加_______,然后观察是否有沉淀生成。
【答案】联合制碱法或侯氏制碱法 化肥(其他合理答案均给分) NH3 NH3+CO2+H2O+NaCl==NH4Cl+NaHCO3↓(或 NH3+CO2+H2O==NH4HCO3 NH4HCO3+NaCl==NaHCO3↓+NH4Cl) CO2 循环I 过滤 稀硝酸 硝酸银溶液
【解析】
联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,沉淀池中发生反应是氨气和水和二氧化碳和氯化钠反应生成氯化铵和碳酸氢铵,主要副产物为氯化铵,可用于化肥或电解液或焊药等,氯化铵的回收利用,可提高原料的利用率,煅烧碳酸氢钠生成碳酸钠。
(1)生产纯碱的方法称联合制碱法或侯氏制碱法,副产品为氯化铵,用途为制作化肥。
(2)向沉淀池中通入两种气体,先通入的是NH3,增大铵根离子的浓度,加入细小食盐颗粒,促进反应正向进行,沉淀池发生的化学反应方程式是![]() 。
。
(3)碳酸氢钠高温煅烧生成碳酸钠和二氧化碳和水,流程中X物质的化学式![]() 。
。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了循环I,将未反应的氯化钠返回沉淀池中,从沉淀池中取出NaHCO3沉淀的操作是过滤。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,先滴加足量的稀硝酸,排除Na2CO3的干扰,稀硝酸和碳酸钠反应生成硝酸钠和水和二氧化碳,再滴加硝酸银溶液,然后观察是否有沉淀生成。