题目内容
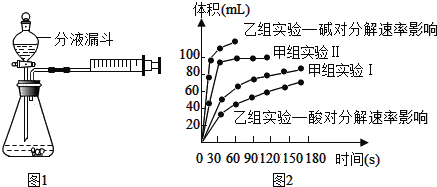
【题目】现甲、乙两化学小组安装两套如图1相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素。
(1)写出上述反应的化学方程式为_____。
(2)甲、乙小组设计如下实验设计方案。
实验编号 | 温度 | 等质量的催化剂 | 浓度 |
甲组实验I | 25℃ | 0.5g二氧化锰 | 10mL3.49%H2O2 |
甲组实验Ⅱ | 25℃ | 0.5g二氧化锰 | 10mL6.8%H2O2 |
实验编号 | 温度 | 等质量的催化剂 | 浓度 | 加入等浓度的试剂(各2mL) |
乙组实验I | 25℃ | 0.5g二氧化锰 | 10mL6.8%H2O2 | 氢氧化钠 |
乙组实验Ⅱ | 25℃ | 0.5g二氧化锰 | 10mL68%H2O2 | 硫酸 |
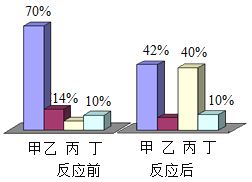
最终实验得到的结果如图2所示,回答下列问题:
①通过甲组实验得出的数据分析,得到的结论是_____;
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析:相同条件下,H2O2在_____(填“酸”或“碱”)性环境下放出气体速率较快。
(3)下列有关H2O2溶液,说法中不正确的是(____)
A H2O2溶液是混合物
B 5.1%的H2O2溶液中氢元素的质量分数为0.3%
C 二氧化锰并不是H2O2分解唯一的催化剂
D H2O2中氢分子和氧分子的个数比为1:1
(4)医学上常用过氧化氢溶液来清洗创口和局部抗菌。为了测定一瓶医用过氧化氢水溶液的溶质质量分数,取该过氧化氢溶液68.0g放入烧杯中然后称量得到108.8g,然后加入2.0g二氧化锰,完全反应后,再称量其质量为110.0g。请回答下列问题:
①生成的氧气为_____g;蒸干烧杯内液体,所得固体物质为_____g。
②试通过计算求该过氧化氢溶液中溶质的质量分数。_____(要有计算过程,结果精确到0.1%)
【答案】2H2O2=2H2O+O2 相同条件下,反应物的浓度越大,反应的速率越快。 碱 BD 0.8 2 2.5%
【解析】
(1)H2O2在二氧化锰作催化剂的条件下反应生成水和氧气,反应的化学方程式是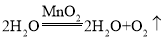 ;
;
故填: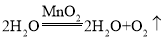 。
。
(2)①通过甲组实验得出的数据分析,得到的结论是相同条件下,反应物的浓度越大,反应的速率越快;
故填:相同条件下,反应物的浓度越大,反应的速率越快。
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,得到的结论,相同条件下,H2O2在碱性环境下放出气体速率较快;
故填:碱。
(3)A、H2O2溶液是过氧化氢溶于水,是混合物,故选项A正确;
B、设过氧化氢溶液的质量为100g
过氧化氢的质量=100g×5.1%=5.1g;氢元素的质量=![]()
水的质量=100g-5.1g=94.9g;氢元素的质量=![]()
5.1%的H2O2溶液中氢元素的质量分数=![]()
故选项B不正确;
C、过氧化氢分解的催化剂有多种,氧化铜、氧化铁等,二氧化锰并不是唯一的催化剂,故选项C正确;
D、H2O2中是氢原子和氧原子的个数比为1:1,故选项D不正确。
故选:BD。
(4)①生成的氧气=108.8g+2.0g-110.0g=0.8g;二氧化锰是催化剂,在反应前后质量不变,蒸干烧杯内液体,固体物质是二氧化锰,其质量为2.0g;
②设生成0.8g氧气需过氧化氢的质量为x
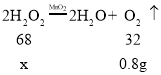
![]()
X=1.7g
该过氧化氢溶液中溶质的质量分数为![]() ;
;
故填:2.5%。

【题目】不同温度时,NaCl固体的溶解度如下表所示。20℃时,将50g NaCl固体加入到盛有100g水的烧杯中,充分溶解得到溶液。下列说法正确的是
温度/℃ | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |

A.烧杯中溶液的质量为150g
B.烧杯中剩余固体的质量为14g
C.溶液中溶质质量分数的计算式为![]() ×100%
×100%
D.升高温度能将烧杯中的饱和溶液变为不饱和溶液