题目内容
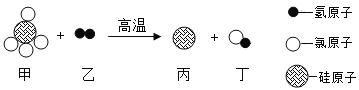
【题目】从陶瓷、玻璃、水泥到电子芯片,硅元素的用途非常广泛。工业制取高纯硅的部分反应原理的微观示意图如图。请回答下列问题:
(1)画出硅原子的结构示意图__________。
(2)甲物质中两种元素的质量比为________。
(3)该反应的化学方程式为___________-。
【答案】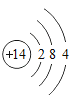 14:71 SiCl4+2H2
14:71 SiCl4+2H2![]() Si+4HCl
Si+4HCl
【解析】
(1)硅原子的原子序数为14,核外电子排布为2、8、4,故硅原子的结构示意图为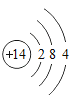 ;
;
(2)由微观示意图可以看出甲物质中含有1个硅原子和4个氯原子,则这两种元素的质量比为(1×28):(4×35.5)=14:71;
(3)由微观示意图可以看出甲为SiCl4,乙为H2,丙为Si,丁为HCl,故反应的化学方程式为SiCl4+2H2![]() Si+4HCl。
Si+4HCl。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
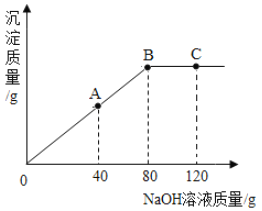
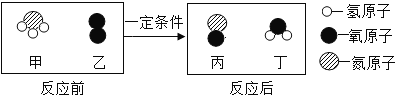
【题目】密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,反应前后各物质质量如表,则下列说法正确的是( )
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量(g) | 4 | 1 | 42 | 10 |
反应后质量(g) | X | 20 | 6 | 31 |
A.乙、丁的相对分子质量比一定为19:21
B.该反应的表达式为:甲+乙→丙+丁
C.X的数值为0
D.参加反应的甲、丙质量比为4:9