题目内容
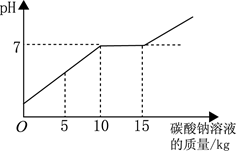
(3分)在完成实验“二氧化碳的制取”后,废液桶中倾倒了含有较多盐酸的混合溶液。为避免酸液污染环境,化学兴趣小组做了如下实验:取废液60g,向其中加入溶质质量分数为21.2%的碳酸钠溶液。所得溶液pH与加入的碳酸钠溶液的质量关系如右图所示:(不考虑CO2溶于水对溶液酸碱性的影响)

(1)通过右图可知,当碳酸钠溶液质量加到 g时,废液中的盐酸恰好处理完。
(2)计算废液中氯化钙的质量分数。

(1)通过右图可知,当碳酸钠溶液质量加到 g时,废液中的盐酸恰好处理完。
(2)计算废液中氯化钙的质量分数。
(1)50g;(2)9.25%。
试题分析:(1)由题意可知,当碳酸钠溶液质量加到50g时,溶液的PH=7,此时废液中的盐酸恰好处理完。
(2)由图可得,加入碳酸钠的质量在50g到75g之间时,溶液的PH一直等于7,此时是碳酸钠与氯化钙反应。故:
解:设溶液中含氯化钙的质量为x
Na2CO3 + CaCl2 CaCO3 ↓ + 2NaCl
106 111
21.2%×25g x
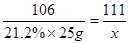
x = 5.55g
C% =
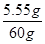 ×100% ="9.25%"
×100% ="9.25%" 答:废液中氯化钙的质量分数9.25%。
点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
溶液的溶质质量分数=
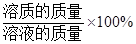 。
。
练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目

 4NH3 + 3O2。计算生产136t NH3所需N2的质量。
4NH3 + 3O2。计算生产136t NH3所需N2的质量。