题目内容
【题目】金属材料在生活中被广泛应用,回答下列问题。
(1)下列说法正确的是___(填序号)
A 武德合金做保险丝是利用了合金熔点变低
B “银粉漆”(铝粉)可涂在铁栏杆上防锈,这是因为铝化学性质稳定
C 生铁和钢的性能不同是由于它们的含碳量不同
D 铝制品表面应常用钢刷擦洗
(2)某同学用如下药品探究铝、镁的活动性,能否达到实验目的__(填能或不能)。
金属种类 | 金属质量 | 酸 |
铝片 | 1g | 10ml5%稀盐酸 |
镁片 | 1g | 10ml5%稀硫酸 |
(3)写出铜和硝酸银溶液反应的化学方程式___。
(4)向Zn(NO3)2、AgNO3、Cu(NO3)2混合溶液中加入一些铁粉,完全反应后过滤.取滤渣于试管中,加稀盐酸,有气体生成.则滤渣的成分是__。
【答案】AC 不能 Cu+2AgNO3 = Cu(NO3)2+2Ag Fe、Cu、Ag(或铁、铜、银)
【解析】
(1)A、根据合金比其中的纯金属熔点变低,硬度增大的特性,武德合金做保险丝是利用了合金熔点变低,A正确;
B 、“银粉漆”(铝粉)可涂在铁栏杆上防锈,这是因为铝化学性质较活泼,易与氧气反应生成一层致密的氧化铝薄膜,B不正确;
C、生铁的含碳量是![]() 和钢的含碳量是
和钢的含碳量是![]() ,所以生铁和钢的性能不同是由于它们的含碳量不同,C正确;
,所以生铁和钢的性能不同是由于它们的含碳量不同,C正确;
D、铝制品表面有一层致密的保护层,不能用钢刷擦洗,会破坏保护层,D不正确。故选AC。
(2)根据表格可知,取1g铝放入10ml5%稀盐酸中,取1g镁放入10ml5%稀硫酸中,通过观察反应现象,比较铝和镁的活动性。该实验不能达到实验目的,因为金属种类不同、酸的种类不同,变量不唯一,无法比较。
(3)铜和硝酸银溶液反应生成银与硝酸铜,化学方程式为Cu+2AgNO3 = Cu(NO3)2+2Ag。
(4)根据金属活动性顺序,铁能置换银和铜,但不能置换锌。向Zn(NO3)2、AgNO3、Cu(NO3)2混合溶液中加入一些铁粉,完全反应后过滤,取滤渣于试管中,加稀盐酸,有气体生成。则滤渣中一定有铁,同时也证明溶液中的AgNO3、Cu(NO3)2已反应完,所以滤渣的成分是铁、铜、银。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】化学实验室常用二氧化锰催化过氧化氢分解的方法制取氧气。那么,影响过氧化氢分解快慢的因素到底有哪些呢?某化学兴趣小组对此进行如下研究。
(提出问题)影响过氧化氢分解快慢的因素有哪些?
(猜想与假设)假设1:过氧化氢溶液的浓度;
假设2:催化剂的质量;
假设3:温度;
假设4:_______。
(设计实验)小明同学设计如下实验方案进行验证。
序号 | H2O2溶液的浓度 | H2O2溶液的质量 | 温度 | MnO2的质量 | 收集O2的体积 | 时间 |
① | 5% | 12 g | 20 ℃ | 0.2 g | 125 mL | 20 s |
② | 30% | 12 g | 20 ℃ | 0.2 g | 125 mL | 2 s |
③ | 30% | 12 g | 40 ℃ | 无 | 125 mL | 148 s |
(1)通过对比实验①和②可知,过氧化氢分解的快慢与_______有关。
(2)在过氧化氢分解前后,二氧化锰的质量和_______不变。
(3)请你写出用二氧化锰催化过氧化氢分解的化学方程式:_______。
(讨论交流)(4)小红同学认为在这个实验中,必须用排水法收集氧气,理由是_______。
(5)小辉同学提出小明的方案无法验证温度对过氧化氢分解快慢的影响,请你帮他说出理由:____。
(拓展延伸)同学们查阅资料得知,FeCl3溶液对过氧化氢分解也有影响。在老师的指导下设计实验继续探究,向两支试管中分别加入等质量、不同浓度的H2O2溶液,再加入等质量、等浓度的FeCl3溶液,分别用气压传感器测定两试管中气体压力的变化曲线,如图1。
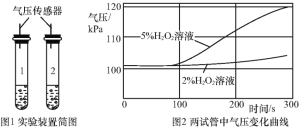
(6)为保证实验的准确性,请你设计向两试管中加入FeCl3溶液的具体方法:__。
(7)请你从图2曲线中找出FeCl3溶液对H2O2分解影响的两条规律性结论:__;____。