题目内容
一定质量的氯化铜和40g盐酸组成的混合溶液中慢慢滴入20%的氢氧化钠溶液并振荡,所加氢氧化钠溶液的质量与生成沉淀的质量的关系如图所示,下列判断中正确的是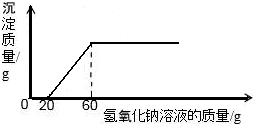
- A.最终生成沉淀的质量为14.7g
- B.40g盐酸的溶质的质量分数是27.375%
- C.生成沉淀的质量随氢氧化钠溶液的滴加而逐渐增多
- D.当加入的氢氧化钠溶液为60g时,所得溶液为氯化钠溶液
D
分析:在有酸存在的情况下,碱总是先与酸反应,等把酸完全消耗掉之后才与其它物质发生反应,所以本题中所发生反应的先后顺序为:(1)NaOH+HCl═NaCl+H2O,(2)CuCl2+2NaOH═Cu(OH)2↓+2NaCl 从图中可以分析出第一个反应所消耗的氢氧化钠溶液的质量为20g,第二个反应所消耗的氢氧化钠溶液的质量为40g.
解答:A设生成沉淀的质量为x,则:
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
80 98n
40g x20% x
=8g
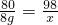
解得:x=9.8g
故A错.
B 设盐酸的质量分数为y,则:
NaOH+HCl═NaCl+H2O
40 36.5
20gx20% 40g?y
=4g
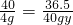
解得:y=9.125%
故B错.
C选项说的不严密,一开始加入氢氧化钠溶液不会产生沉淀,到最后把氯化铜消耗完之后,也不会再产生沉淀故 C错
D由上分析中所发生的两个化学反应及图可知,加入60g氢氧化钠溶液时,恰好把氯化铜和盐酸消耗掉,所以最后所得溶液中的溶质只有氯化钠也就是氯化钠溶液,故D正确.
故选D
点评:这类题应该首先分析所发生的化学反应,然后根据反应的化学方程式及题给条件进行求算,如果学生熟练掌握酸碱盐两两之间的反应,及根据化学方程式的计算,这些问题都很容易解决了.
分析:在有酸存在的情况下,碱总是先与酸反应,等把酸完全消耗掉之后才与其它物质发生反应,所以本题中所发生反应的先后顺序为:(1)NaOH+HCl═NaCl+H2O,(2)CuCl2+2NaOH═Cu(OH)2↓+2NaCl 从图中可以分析出第一个反应所消耗的氢氧化钠溶液的质量为20g,第二个反应所消耗的氢氧化钠溶液的质量为40g.
解答:A设生成沉淀的质量为x,则:
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
80 98n
40g x20% x
=8g
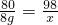
解得:x=9.8g
故A错.
B 设盐酸的质量分数为y,则:
NaOH+HCl═NaCl+H2O
40 36.5
20gx20% 40g?y
=4g
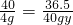
解得:y=9.125%
故B错.
C选项说的不严密,一开始加入氢氧化钠溶液不会产生沉淀,到最后把氯化铜消耗完之后,也不会再产生沉淀故 C错
D由上分析中所发生的两个化学反应及图可知,加入60g氢氧化钠溶液时,恰好把氯化铜和盐酸消耗掉,所以最后所得溶液中的溶质只有氯化钠也就是氯化钠溶液,故D正确.
故选D
点评:这类题应该首先分析所发生的化学反应,然后根据反应的化学方程式及题给条件进行求算,如果学生熟练掌握酸碱盐两两之间的反应,及根据化学方程式的计算,这些问题都很容易解决了.

练习册系列答案
相关题目
 铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
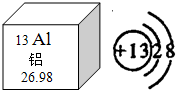
(1)①铝在地壳中的含量居所有金属元素的第______位,根据铝元素在元素周期表中的“身份证”,铝元素的原子序数为______,如图微粒结构示意图表示______(填序号)
A.铝原子 B.铝离子 C.铝分子
②工业上用电解氧化铝制取金属铝,同时生成一种常见的气体.反应的方程式为______.
③工业上从铝土矿中获得氧化物X,从空气中获得氮气,再将物质X、N2和碳在一定条件下反应制得AlN和CO.化学反应方程式为______.
(2)铝合金比单质铝有着更为广泛的应用.已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
[查阅资料]铝与氢氧化钠溶液反应方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
[猜 想]猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有______.
猜想3:该合金粉末中除铝外,还含有铁、铜.
[实验探究]下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的30%NaOH溶液,充分反应后过滤,滤渣备用. | 粉末部分溶解,并有气体放出. | 合金中一定含有______. |
| ②取步骤①所得滤渣,加过量的______,充分反应. | 滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有______. |
[反 思]一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.等质量铝与足量盐酸反应生成的氢气比其与足量氢氧化钠溶液生成的氢气______(选填序号)
A.多 B.少 C.相等 D.无法比较
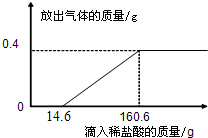
(3)在烧杯中加入4.28g久置空气中的铝箔,再滴加稀盐酸,放出气体的质量与所加稀盐酸质量的关系如右图所示.请回答下列问题:

①产生氢气______g.
②刚开始没有氢气放出的原因是铝箔表面有______(选填“致密”或“疏松”)的氧化层.氧化层与稀盐酸反应生成易溶于水的氯化铝和水,反应方程式为______.
③所滴加的稀盐酸中溶质的质量分数.
 铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.