题目内容
【题目】下图是实验室制取气体的一些装置,据图回答有关问题。
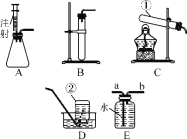
(1)写出指定仪器的名称:①___________;②___________;
(2)写出一个实验室用装置B制取气体的反应的化学方程式_____________________;
(3)实验室在常温下用块状电石与水反应制取乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放热引起发生装置炸裂。你认为上图中最适合制取乙炔气体的发生装置是_____(填装置序号);如果用E图所示装置收集乙炔,气体应从_______(填“a”或“b”)端管口通入。
【答案】试管集气瓶CaCO3+2HCl=CaCl2+H2O+CO2↑(或2H2O2![]() 2H2O+ O2↑或Zn + H2SO4 === ZnSO4 + H2↑)Ab
2H2O+ O2↑或Zn + H2SO4 === ZnSO4 + H2↑)Ab
【解析】
(1)据常用仪器回答;
(2)装置B属于固—液常温型,实验室用二氧化锰催化过氧化氢制取氧气可用此装置,制取二氧化碳和氢气也可用此装置;
(3)常温下用块状电石与水反应制取乙炔气体,该反应必须严格控制加水速度,注射器可逐滴滴加液体,进而可控制加水速度;乙炔的密度小于水。
(1)①是试管,②是集气瓶;
(2)装置B属于固—液常温型,石灰石和稀盐酸制二氧化碳,过氧化氢与二氧化锰混合制氧气,锌与稀硫酸反应制氢气均可此装置,石灰石(或大理石)主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;过氧化氢与二氧化锰混合反应生成水和氧气,反应化学方程式为:2H2O2![]() 2H2O+ O2↑;锌与稀硫酸反应生硫酸锌和氢气,反应化学方程式为:Zn + H2SO4 = ZnSO4 + H2↑;
2H2O+ O2↑;锌与稀硫酸反应生硫酸锌和氢气,反应化学方程式为:Zn + H2SO4 = ZnSO4 + H2↑;
(3)电石与水反应时,如果不控制反应物的量,有可能引起发生装置炸裂,A装置中的注射口器能够很好地控制加水速度,最适合制取乙炔气体的发生装置;乙炔密度小于水,如果用E图所示装置收集乙炔,气体应从气体从b进入,能够把水从a中排出。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】某食品的包装袋中放有一小包“防腐剂”,化学兴趣小组的同学对“防腐剂”的成分产生了好奇,他们将一包“防腐剂”倒在滤纸上,看到“防腐剂”中有一些灰黑色粉末和一些红色粉末,为此,展开以下探究活动:
(提出问题)“防腐剂”中灰黑色的粉末和红色的粉末分别是什么?
(查阅资料)食品腐败主要是因为食品易被空气中的氧气和水蒸气氧化、潮解而变质,使用“防腐剂”可延长食品的保质期;氧化铁可与稀盐酸反应生成氯化铁和水,其溶液因电解出铁离子而呈黄色。
(提出猜想)小明:“防腐剂”中灰黑色的粉末是氧化铜,红色的粉末是铜。
小红:“防腐剂”中灰黑色的粉末是氧化铜和碳粉,红色的粉末是铜。
小军:“防腐剂”中灰黑色的粉末是铁粉和碳粉,红色的粉末是氧化铁。
(讨论分析)通过讨论,同学们一致认为小军的猜想是正确的。理由是:_______________________。
(实验探究)请你参与他们的探究,并将实验内容补充完整。
实验步骤及操作 | 实验现象 | 实验结论 |
用磁铁接近滤纸上的“防腐剂”,并充分吸引。 | 磁铁上吸引 了部分黑色物质 | ___________________ |
② 取①中剩余的粉末于试管中,加入足量的_________,观察现象。 | _________________________________ | 小军猜想成立,写出化学 方程式: _________________________ |
(拓展探究)为了进一步探究“防腐剂”的性质,兴趣小组的同学另取一包“防腐剂”粉末装入硬质玻璃管中,进行了如图所示的实验。
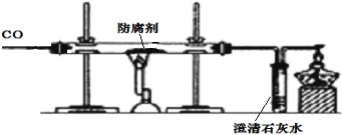
(1)该实验表现出CO具有的化学性质是___________________________。其实际操作中用量比理论值大的原因是____________________________________________。
(2)实验结束后,通过称量反应前后硬质玻璃管中固体物质的质量,他们发现反应后红色固体物质变成黑色而且的质量减小,质量减小的原因______________________。