题目内容
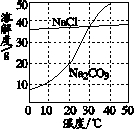 如图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线,请回答问题.
如图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线,请回答问题.(1)氯化钠和碳酸钠溶解度相等时的温度为
(2)20℃时,碳酸钠饱和溶液中,溶质与溶剂的质量比为
(3)生活在盐湖附近的人们习惯“夏天晒盐,冬天捞碱”,其原因是
(4)向氯化钠、碳酸钠的混合溶液中加入一定量的氢氧化钙溶液,会发生如下反应:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,反应后溶液中溶质的组成为(写出所有可能)
分析:(1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)溶液具有均一性,并据该温度下碳酸钠的溶解度分析;
(3)运用氯化钠的溶解度受温度影响小,碳酸钠的溶解度随温度的升高而而增大分析解答;
(4)根据碳酸钠和氢氧化钙反应的生成物及反应物是否过量分析解答.
(2)溶液具有均一性,并据该温度下碳酸钠的溶解度分析;
(3)运用氯化钠的溶解度受温度影响小,碳酸钠的溶解度随温度的升高而而增大分析解答;
(4)根据碳酸钠和氢氧化钙反应的生成物及反应物是否过量分析解答.
解答:解:(1)30℃时氯化钠和碳酸钠溶解度交于一点,说明此时二者的溶解度相等;
(2)溶液具有均一性,所以20℃时碳酸钠饱和溶液中,溶质与溶剂的质量比是一样的,该温度下碳酸钠的溶解度是20g,即100g水中最多溶解20g的碳酸钠,溶质与溶剂的质量比是:1:5;
(3)据图示可知:氯化钠溶解度受温度影响变化不大,碳酸钠溶解度受温度影响变化较大,夏天水分蒸发快,所以主要析出的是氯化钠,冬天温度降低,碳酸钠的溶解度减小,结晶析出;
(4)向氯化钠、碳酸钠的混合溶液中加入一定量的氢氧化钙溶液,会发生如下反应:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,氯化钠和氢氧化钙不反应,所以反应后溶液中一定含有氯化钠;若碳酸钠和氢氧化钙恰好完全反应,则反应后溶液中还含有氢氧化钠,若碳酸钠过量,则溶质还含有碳酸钠,若氢氧化钙过量,溶质还含有氢氧化钙;所以溶质的组成为:NaCl、NaOH;NaCl、NaOH、Na2CO3;NaCl、NaOH、Ca(OH)2;
故答案为:(1)30℃;
(2)1:5;
(3)氯化钠溶解度受温度影响变化不大,碳酸钠溶解度受温度影响变化较大;
(4)氯化钠、氢氧化钠;氯化钠、氢氧化钠、碳酸钠;氯化钠、氢氧化钠、氢氧化钙 (或NaCl、NaOH;NaCl、NaOH、Na2CO3;NaCl、NaOH、Ca(OH)2).
(2)溶液具有均一性,所以20℃时碳酸钠饱和溶液中,溶质与溶剂的质量比是一样的,该温度下碳酸钠的溶解度是20g,即100g水中最多溶解20g的碳酸钠,溶质与溶剂的质量比是:1:5;
(3)据图示可知:氯化钠溶解度受温度影响变化不大,碳酸钠溶解度受温度影响变化较大,夏天水分蒸发快,所以主要析出的是氯化钠,冬天温度降低,碳酸钠的溶解度减小,结晶析出;
(4)向氯化钠、碳酸钠的混合溶液中加入一定量的氢氧化钙溶液,会发生如下反应:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,氯化钠和氢氧化钙不反应,所以反应后溶液中一定含有氯化钠;若碳酸钠和氢氧化钙恰好完全反应,则反应后溶液中还含有氢氧化钠,若碳酸钠过量,则溶质还含有碳酸钠,若氢氧化钙过量,溶质还含有氢氧化钙;所以溶质的组成为:NaCl、NaOH;NaCl、NaOH、Na2CO3;NaCl、NaOH、Ca(OH)2;
故答案为:(1)30℃;
(2)1:5;
(3)氯化钠溶解度受温度影响变化不大,碳酸钠溶解度受温度影响变化较大;
(4)氯化钠、氢氧化钠;氯化钠、氢氧化钠、碳酸钠;氯化钠、氢氧化钠、氢氧化钙 (或NaCl、NaOH;NaCl、NaOH、Na2CO3;NaCl、NaOH、Ca(OH)2).
点评:本题主要考查了据溶解度曲线分析解答问题的能力,以及物质反应后的溶液中溶质要考虑反应物是否完全反应、是否过量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
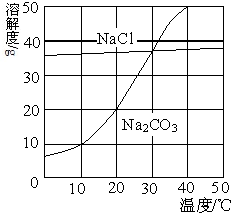
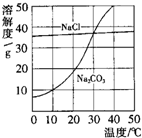 如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题:
如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题: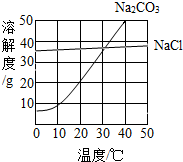 (2013?佛山)如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题;
(2013?佛山)如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题;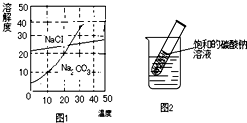 如图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线.
如图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线.