题目内容
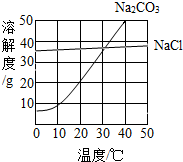 (2013?佛山)如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题;
(2013?佛山)如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题;(1)碳酸钠和氯化钠混合溶液的pH
>
>
7(填“<”、“=”或“>”).(2)40℃时,碳酸钠的溶解度为
50
50
g.(3)大于30℃时,碳酸钠的溶解度
>
>
氯化钠的溶解度(填“<”、“=”或“>”).(4)40℃时,碳酸钠和氯化钠均饱和的混合溶液,当温度降低到20℃时,析出主要物质是
Na2CO3
Na2CO3
(填化学式).(5)为检验(4)中析出的物质,取少量样品于试管中加入足量稀
HCl
HCl
(填化学式)溶液.溶解,并有气体产生,再加入几滴稀AgNO3
AgNO3
(填化学式)溶液,有白色沉淀产生.分析:(1)根据碳酸钠显碱性,氯化钠显中性考虑;(2)根据溶解度的查法考虑;(3)根据溶解度曲线在上边的溶解度就大考虑;(4)根据降温后溶解度减小的多的析出的晶体就多;(5)根据碳酸盐与盐酸反应能产生气体,氯离子与银离子结合能产生白色沉淀进行分析.
解答:解:(1)碳酸钠显碱性,氯化钠显中性,所以二者的混合物显碱性,溶液的pH值>7;
(2)从40℃向上作垂线,与碳酸钠的交点再向纵坐标作垂线,所以碳酸钠的溶解度是50g;
(3)大于30℃时,碳酸钠的溶解度曲线在氯化钠溶解度曲线的上边,所以大于30℃时,碳酸钠的溶解度>氯化钠的溶解度;
(4)降温后溶解度减小的多的析出的晶体就多,由溶解度曲线可知40℃时,碳酸钠和氯化钠均饱和的混合溶液,当温度降低到20℃时,碳酸钠溶解度减小的多,所以析出的晶体主要是碳酸钠;
(5)检验碳酸钠时加入稀盐酸,盐酸与碳酸钠反应生成氯化钠、水、二氧化碳,所以有气泡产生,说明含有碳酸钠,碳酸钠与盐酸反应生成氯化钠、水、二氧化碳,再滴加硝酸银溶液,氯化钠与硝酸银反应生成氯化银白色沉淀.
故答案为:(1)>;(2)50;(3)>;(4)Na2CO3;(5)HCl;AgNO3.
(2)从40℃向上作垂线,与碳酸钠的交点再向纵坐标作垂线,所以碳酸钠的溶解度是50g;
(3)大于30℃时,碳酸钠的溶解度曲线在氯化钠溶解度曲线的上边,所以大于30℃时,碳酸钠的溶解度>氯化钠的溶解度;
(4)降温后溶解度减小的多的析出的晶体就多,由溶解度曲线可知40℃时,碳酸钠和氯化钠均饱和的混合溶液,当温度降低到20℃时,碳酸钠溶解度减小的多,所以析出的晶体主要是碳酸钠;
(5)检验碳酸钠时加入稀盐酸,盐酸与碳酸钠反应生成氯化钠、水、二氧化碳,所以有气泡产生,说明含有碳酸钠,碳酸钠与盐酸反应生成氯化钠、水、二氧化碳,再滴加硝酸银溶液,氯化钠与硝酸银反应生成氯化银白色沉淀.
故答案为:(1)>;(2)50;(3)>;(4)Na2CO3;(5)HCl;AgNO3.
点评:解答本题关键是要知道溶解度的比较方法,检验碳酸根离子用稀盐酸,降温后溶解度减小就会析出晶体,溶解度减小的数值越大,析出的晶体越多.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2013?佛山)如图是稀HCl和NaOH溶液反应的pH变化曲线图.以下说法正确的是( )
(2013?佛山)如图是稀HCl和NaOH溶液反应的pH变化曲线图.以下说法正确的是( )
 (2013?佛山)如图,A、B、C、D、E是初中化学中常见的物质,转化关系(其中部分生成物和反应条件已忽略):已知B是黑色固体、相对分子质量为80,E是天然气的主要成份.请回答下列问题:(1)B是
(2013?佛山)如图,A、B、C、D、E是初中化学中常见的物质,转化关系(其中部分生成物和反应条件已忽略):已知B是黑色固体、相对分子质量为80,E是天然气的主要成份.请回答下列问题:(1)B是