题目内容
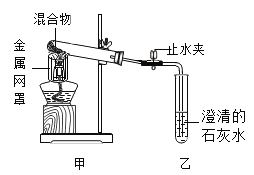
【题目】某化学活动兴趣小组用如图1装置进行木炭还原氧化铜的探究实验,反应一段时间后,,甲中试管内黑色粉末全部变成红色,乙中澄清石灰水变浑浊。
(1)写出木炭还原氧化铜的化学方程式_____________。
(2)待反应结束,先将导气管从石灰水中取出,然后关闭止水夹,让产物自然冷却。若罩不关闭止水夹,可能出现的问题是___________。
[查阅资料]木炭还原氧化铜在反应过程中,有可能生成氧化亚铜(Cu2O),氧化亚铜为红色固体。
[探究一]同学们对反应后玻璃管中的红色粉末是否含有氧化亚铜展开探究,已知氧化亚铜能与稀硫酸反应:![]() 。取少量红色固体于试管中,加入过量的稀硫酸,观察到______________,说明红色粉末中含有Cu2O。
。取少量红色固体于试管中,加入过量的稀硫酸,观察到______________,说明红色粉末中含有Cu2O。
[探究二]有同学提出,木炭还原氧化铜的过程中,除了会生成氧化亚铜,还有可能生成一氧化碳,他的依据是___________。于是他重复实验并收集反应生成的气体,将气体干燥后,再通过灼热的氧化铜,观察到有___________,色固体生成,说明有CO生成。
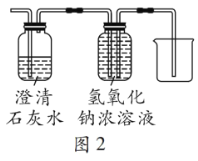
[反思与评价]根据以上探究,有同学认为原实验装置存在不足,于是将乙装置改进为如图2所示,改进后装置的优点是__________。
【答案】 铜重新被氧化成氧化铜(或红色的铜重新被氧化成黑色的氧化铜等合理即可) 溶液变蓝 化学反应前后,元素的种类不变(或质量守恒定律) 红 吸收二氧化碳并收集一氧化碳,防止污染空气
铜重新被氧化成氧化铜(或红色的铜重新被氧化成黑色的氧化铜等合理即可) 溶液变蓝 化学反应前后,元素的种类不变(或质量守恒定律) 红 吸收二氧化碳并收集一氧化碳,防止污染空气
【解析】
(1)木炭还原氧化铜时,生成铜和二氧化碳,反应的化学方程式为 ;
;
(2)实验结束后,先将导气管从石灰水中取出,然后关闭止水夹,让产物自然冷却,若不关闭止水夹,空气进入试管中,铜重新被氧化成氧化铜(或红色的铜重新被氧化成黑色的氧化铜等)
[探究一]
根据进行的操作、得出的结论,结合[查阅资料]氧化亚铜能和稀硫酸反应生成硫酸铜溶液,故观察到的现象是溶液由无色变为蓝色。
[探究二]
木炭还原氧化铜的过程中,除了会生成氧化亚铜,还有可能生成一氧化碳,原因是化学反应前后,元素的种类不变。一氧化碳可与灼热的氧化铜反应生成铜和二氧化碳,则观察到的现象是有红色固体生成。
[反思与评价]
根据探究可知木炭还原氧化铜时有CO生成,CO会污染空气,改进后装置中的氢氧化钠浓溶液既可吸收CO2,又可将溶液排出达到收集CO的目的,防止污染空气。

 名校课堂系列答案
名校课堂系列答案【题目】如图为实验室常见的气体制备、收集和性质的实验装置,据图回答。
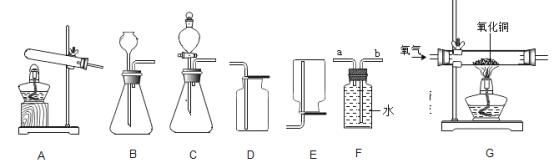
(1)推出C、D装置中标号仪器名称:X_____、Y_____。
(2)O2的制取方法有多种,若用加热氯酸钾的方法制取O2,应选用的发生装置为_____(填装置序号,下同),反应方程式为:_____。
(3)小海同学在装置B中加入15%的过氧化氢溶液和二氧化锰制取氧气。
①若用F装置收集氧气,氧气应从_____(填“a”或“b”)端通入。
②实验中发现不能得到平稳的氧气流。小涛同学提出可以从两个方面加以改进:
一是将制取的装置B换为上图中的装置_____;
二是将过氧化氢溶液加水稀释。如果在80g溶质质量分数为15%的过氧化氢溶液中加入70克水,则所得溶液的溶质质量分数为_____。
(4)实验室用加热氯化铵和氢氧化钙固体混合物制取氨气,生成氨气的化学方程式为_____,为探究氨气的性质,小红用图中G装置进行氨气与氧化铜反应的实验,实验中观察到黑色氧化铜粉末变成红色。
(提出问题)得到的红色粉末是什么?
查阅资科:Cu2O是红色,易与稀硫酸反应:![]()
(猜想假设)红色粉末是①Cu②Cu2O③_____
(设计实验)小明设计如下实验验证红色粉末中是否含有Cu2O
实验步骤 | 实验现象 | 实检站论 |
取红色粉末于试管中,加入足量稀硫酸 | _____ | 红色粉末中含有Cu2O |
(实验反思)小明设计的实验无法证明红色粉末中是否含有Cu,原因是_____。