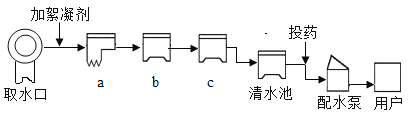
题目内容
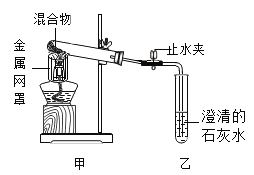
【题目】某同学为探究生石灰暴露空气中的变质情况,设计如下实验:称取生石灰w,露置空气一段时间后,所得粉末A的质量为1.2w,加入足量稀盐酸,生成气体B,依次通入浓硫酸,足量澄清石灰水,得到沉淀0.25w。推断粉末A的组成________(写清楚成分及其对应质量),计算粉末A 中氧化钙的质量分数________。
【答案】CaO 0.58w 、Ca(OH)2,0.37w、 CaCO3,0.25w 48.3%
【解析】
加入足量稀盐酸,生成气体B,依次通入浓硫酸,足量澄清石灰水,得到沉淀0.25w,0.25w就是二氧化碳与氢氧化钙反应生成碳酸钙的质量;二氧化碳又是粉末A中的碳酸钙与稀盐酸反应得到,依据:CaCO3→CO2→CaCO3得,粉末A中的碳酸钙的质量就是0.25w;
设生成0.25w的碳酸钙需要二氧化碳的质量是x
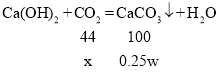
![]()
x=0.11w
生石灰的质量是w,露置空气一段时间后,所得粉末A的质量为1.2w,固体增重的质量=1.2w-w=0.2w;也就是增加了0.11w的二氧化碳,剩余的0.2w-0.11w=0.09w,就是生石灰吸收的水的质量;
设与0.09w的水反应生成的氢氧化钙的质量是y
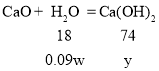
![]()
y=0.37w
则粉末A的中CaO的质量=1.2w-0.37w-0.25w=0.58w
粉末A的组成是:CaO 0.58w 、Ca(OH)2 0.37w、 CaCO3 0.25w
故填:CaO 0.58w 、Ca(OH)2 0.37w、 CaCO3 0.25w。
粉末A 中氧化钙的质量分数=![]()
故填:48.3%。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】在一个密闭容器中有A、B、C、D 四种物质,在一定条件下反应,各物质组成见下表 1。下列说法正确的是()
| A | B | C | D |
反应前 | 70% | 14% | 6% | 10% |
反应x分钟 | a | 11% | c | d |
反应y分钟 | 42% | b | 40% | 10% |
表1容器各组分物质质量分数随反应时间的变化情况
A.图 中 a=56%
B.该反应为化合反应,且一定存在元素化合价的升降
C.D是催化剂
D.若反应可以进行彻底则B有剩余
【题目】四种物质在一定条件下充分混合反应,测得反应前后各物质的质量分数如图所示,则有关说法中不正确的是
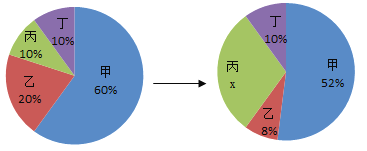
A.X的数值是30%
B.丙一定属于化合物
C.参加反应的甲和乙的质量比为13:2
D.丁可能不参与反应
【题目】如图是部分元素的离子结构示意图和元素周期表的一部分。请回答:
| ||||||
| ||||||
|
| |||||
(1)图①、②中属于阴离子的是______(填序号),该元素的质子数为______;13号元素原子的最外层电子数为______。

(2)由表中原子序数为1、8、13的元素组成物质的化学式为______。