题目内容
【题目】实验是学习化学的一种重要手段。
(1)如图是实验室制备气体常用的装置。
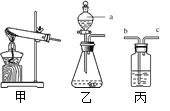
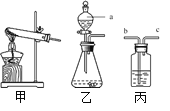
① 装置乙中仪器a的名称是_______,在该装置中它的作用主要是_______。
② 实验室用KClO3和MnO2制取O2时,应选用___________(填序号)作为发生装置,该反应的化学方程式为________。
③ 若用丙装置干燥O2,丙中盛放的试剂名称为_______,气体应从_______(填“b”或“c”)端通入。
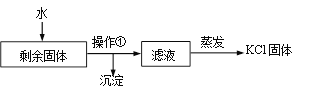
(2)实验完全结束后,某同学要从剩余固体中提取KCl,实验流程如下:
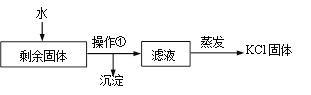
① 为了加快剩余固体在水中的溶解,可采取的一种措施是________。
② 流程中“操作①”的名称是________。
③ 玻璃棒在“蒸发”过程中搅拌的目的是_________。
【答案】 分液漏斗 控制反应的速率 甲 2KClO3![]() 2KCl+3O2↑ 浓硫酸 b 热水溶解(或加热、或将固体研碎、或搅拌等) 过滤 让液体受热均匀,防止局部过热引起飞溅
2KCl+3O2↑ 浓硫酸 b 热水溶解(或加热、或将固体研碎、或搅拌等) 过滤 让液体受热均匀,防止局部过热引起飞溅
【解析】本题考查了常见气体制取和混合物的分离。
(1) ① 装置乙中仪器a的名称是分液漏斗,分液漏斗能够控制液体药品的流量,从而可以控制反应速率,在该装置中它的作用主要是控制反应的速率;
② 实验室用KClO3和MnO2制取O2需要加热,属于固体加热型,应选用甲作为发生装置,KClO3和MnO2加热时生成了氯化钾和氧气,该反应的化学方程式为2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
③ 浓硫酸具有吸水性,若用丙装置干燥O2,丙中盛放的试剂名称为浓硫酸,为了能使气体与浓硫酸充分接触,气体应从b端通入;
(2) ① 为了加快剩余固体在水中的溶解,可采取的一种措施是热水溶解(或加热、或将固体研碎、或搅拌等) ;
②“操作①”是将固体和液体分离,流程中“操作①”的名称是过滤;
③ 玻璃棒在“蒸发”过程中搅拌的目的是让液体受热均匀,防止局部过热引起飞溅。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】分析处理图表的信息是学习化学的一种重要方法。下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
温度/℃ | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
(1)40 ℃时,氯化钠的溶解度为________g。
(2)碳酸钠的溶解度随温度的升高而________(填“增大”或“减小”)。在20 ℃时,在100 g的水中加入30 g碳酸钠,充分搅拌后得到的是________(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30 ℃,该溶液的溶质质量分数为________(计算结果精确到0.1%)。
(3)10 ℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是________________________________________________________________________。