题目内容
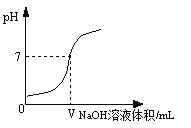
【题目】将0.4%的氢氧化钠溶液滴加到2mL0.4%的盐酸中,测得混合液的pH变化曲线如图。某学习小组对加入0—— VmL氢氧化钠过程中,所得混合液pH增大原因进行了如下探究:
【猜想假设】
猜想Ⅰ:pH增大是因为 ;
猜想Ⅱ:pH增大是因为发生了反应,写出反应方程式 。
【实验探究】
为验证猜想Ⅱ,请你帮助该小组完成下列实验。(可供选择的实验用品有:pH计、0.4%的氢氧化钠溶液、0.4%的盐酸、水。)
(1)向2mL0.4%的盐酸中加入VmL0.4%的氢氧化钠溶液,用pH计测得混合液的pH=7。
(2)向2mL0.4%的盐酸中加入VmL ,用pH计测得混合液的pH 7(填“>”、“=”或“<”)。综合(1)和(2)证明猜想Ⅱ成立。
【答案】【猜想假设】猜想Ⅰ :盐酸被NaOH溶液稀释(或混合后溶液体积增大);猜想Ⅱ:NaOH+HCl=NaCl+H2O;【实验探究】 水; <
【解析】
试题分析:根据所学知识可知,盐酸与氢氧化钠溶液混合,PH增大的原因可能是盐酸的与氢氧化钠溶液反应或溶液的体积增大造成的,故作出【猜想假设】猜想Ⅰ:pH增大是因为盐酸被NaOH溶液稀释(或混合后溶液体积增大);猜想Ⅱ:pH增大是因为发生了反应的反应方程式为:NaOH+HCl=NaCl+H2O;【实验探究】(1)向2mL0.4%的盐酸中加入VmL0.4%的氢氧化钠溶液,用pH计测得混合液的pH=7。(2)向2mL0.4%的盐酸中加入VmL水用pH计测得混合液的pH<7;综合(1)和(2)证明猜想Ⅱ成立。

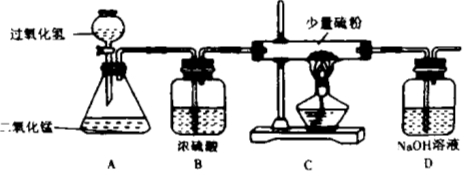
【题目】除去下列物质中的少量杂质,所选用试剂及操作方法均正确的是
选项 | 物质(括号内为杂质) | 选用试剂 | 操作方法 |
A | CO2(CO) | 过量O2 | 点燃 |
B | CaO(CaCO3) | 足量蒸馏水 | 过滤、蒸发 |
C | NaCl溶液(MgSO4溶液) | 适量BaCl2溶液 | 过滤 |
D | FeCl2溶液(CuCl2溶液) | 足量铁粉 | 过滤 |