题目内容
人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断地发生变化,金属制品因其美观、耐用、轻便易成型而被人们广泛利用,请根据所学知识及生活知识参与有关金属制品探究.
(1)以下工具的制作过程中没有发生化学变化的是(________)
A.原始人制作石刀;B.冶炼青铜;C.炼铁
(2)请将以下金属材料的冶炼按年代的先后顺序排序________(填序号).
A.铁;B.青铜;C.铝
从以上顺序可以看出,金属制品的出现顺序与________有关,那么金属钾的制得应排在
________之后.
(3)金属区别于非金属的主要物理性质是,金属具有________,金属区别于非金属的主要化学特征是在化学变化中金属原子通常表现为________.
(4)孔雀石主要成分为碱式碳酸铜,经加热会发生反应:Cu2(OH)2CO3 2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:________
2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:________
(5)古代术士将炉甘石(主要成分为ZnCO3)与赤铜矿(Cu2O)、木炭放在炼炉中高温灼烧,炼出金光灿灿的“黄金”,被称为“炼石成金”.
①请你用学过的知识回答,真的可以“炼石成金”吗?
________.
②那么你认为这金光灿灿的金属是什么?它是怎么炼出来的?写出有关化学方程式
该金属可能是________,炼出它的化学方程式为________、________、________.
(6)到西汉时期我国的劳动人民又发明了“湿法炼铜”,在西汉刘安所著的《淮南万毕术》中就有“曾青得铁则化为铜”的记载(“曾青”是指铜的化合物),请用反应方程式表示其冶炼原理:________
(7)磁悬浮的核心技术得制备超导材料.有一种超导材料的化学式为Y2BaCu6O10,它是以YmOn、BaCO3和CuO为原料经研磨烧结而成.假设此过程中所有元素的化合价不变,试填写以下空白:
a.超导材料Y2BaCu6O10是由________种元素组成的,YmOn的化学式是:________
b.在合成该超导材料的同时还生成-种产物,该物质是________(写化学式).
金属的使用及冶炼历史也引起同学们极大兴趣,初三同学组织化学兴趣小组继续进行(8)(9)探究:
(8)首先他们收集大量有关钢铁的成语与民间谚语.其中有说明钢的性能比铁好的有________,知道“百炼成钢”是指铁在高温条件下反复敲打发生的反应是:________,从而了解钢与铁的机械性能不同是因为两者________.
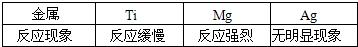
(9)钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.
[提出假设]a. Ti的金属活动性比Mg强;
b.Ti的金属活动性介于Mg和Ag之间.
[查阅资料]在相同条件下,金属与酸反应,产生气泡的速率越快,则该金属活动性越强.
[实验设计]同温下,取大小相同的这三种金属薄片,分别投入等体积、等浓度的足量稀盐酸中,观察现象.
请回答:三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是________.
[实验现象]
| 金属 | Ti | Mg | Ag |
| 反应现象 | 反应缓慢 | 反应强烈 | 无明显现象 |
[结论]用不同浓度的足量稀盐酸反应,是否也能得出同样结论?________,请说明理由________
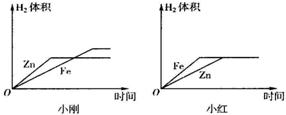
(10)小刚与小红分别做相同质量的不同金属与同质量、同质量分数的稀H2SO4反应的实验,实验
结束后,分别交上的实验报告,并绘制出金属Zn、Fe分别与稀H2SO4反应放出H2的函数图象(如图所示).
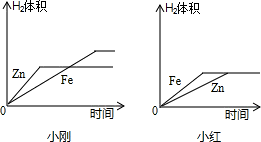
两个图象中存在有错误的是________的图象,判断错误的理由是________,
图象不同的原因是________.
由该实验可以得到的结论:
①金属与酸反应的速率与________有关.
②金属与酸反应中若生成盐中金属价态相同,则生成的氢气量与________有关.
(11)将铁粉加到一定量的硝酸银、硝酸铜、硝酸锌的混合溶液中,充分反应后过滤,在滤液中滴加盐酸,没有白色沉淀生成,则滤渣中一定有________,肯定滤液中有________.
(12)现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一
种,现欲测定其组成.
[查阅资料]Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn一119,Ni一59.
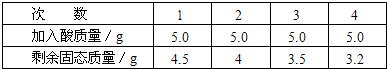
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
| 次数 | 1 | 2 | 3 | 4 |
| 加入酸质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
解:
(1)青铜、铁都是金属,需要经过冶炼才能得到,冶炼就一定会涉及到化学反应.石刀是石头做的,石头在自然界都有,用石头制取石刀,只是物体形态发生变化而不会涉及到化学变化.故选A
(2)春秋时期,铁器在生产中广泛使用,青铜出现在夏朝.铝的冶炼只有100多年的历史,因此顺序为BAC.由题可知,活动性越强的金属,金属制品出现的越晚.金属制品的出现顺序与金属活性有关.故选B、A、C;金属活动性、C
(3)大多数金属都具有金属光泽,具有良好的延展性和导电、导热性,除汞外,金属在常温下都是固体.故答案为:金属光泽,良好的传热导电性,延展性易;失去电子
(4)由Cu2(OH)2CO3 2CuO+H2O+CO2↑可得到氧化铜,氧化铜经过碳还原产生铜.故答案为:2CuO+C
2CuO+H2O+CO2↑可得到氧化铜,氧化铜经过碳还原产生铜.故答案为:2CuO+C 2Cu+CO2↑
2Cu+CO2↑
(5)在化学变化过程中元素种类不可能发生变化,所谓的“金”不过是炉甘石、赤铜矿和碳在高温下还原反应产生的铜锌合金.故答案为:不能,在化学变化过程中元素种类不可能发生改变;铜锌合金;ZnCO3 ZnO+CO2↑;2ZnO+C
ZnO+CO2↑;2ZnO+C 2Zn+CO2↑;2Cu2O+C
2Zn+CO2↑;2Cu2O+C 4Cu+CO2↑
4Cu+CO2↑
(6)曾青主要成分是CuSO4、Cu(OH)2,易溶于苦酒(醋),又叫白青、空青.东汉时的《神农本草经》也有:“石胆…能化铁为铜”的话,石胆或胆矾,成分是含水硫酸铜CuSO45H2O.故答案为:Fe+CuSO4═Cu+FeSO4
(7)超导材料的化学式为Y2BaCu6O10,可知该材料有四种元素组成;根据正、负化合价的代数和为零的原则得出YmO2的化学式是Y3O2碳酸钡在高温的条件下生成氧化钡和二氧化碳,因此该物质为二氧化碳.故答案为:四;Y2O3;CO2;
(8)生铁含碳量大于2.0%;钢含碳量小于2.0%.钢是由生铁再炼而成的,有较高的机械强度和韧性,具有耐热、耐腐蚀、耐磨等特殊性能.故答案为:恨铁不成钢;C+O2 CO2;含碳量不等
CO2;含碳量不等
(9)根据反应速率越快,金属活动性越强的原则可知a的假设是错误的.而且反应速率与反应物的浓度有关.
故答案为:除去氧化膜利于直接反应;a;镁反应速率比钛快;否;反应速率与反应物浓度有关;
(10)金属与酸反应的速率与金属活性有关,金属与酸反应中若生成盐中金属价态相同,则生成的氢气量与相对原子量有关.故答案为:小红;图象中Fe与Zn标反了,Zn的反应速率较Fe快;小刚取的金属量较少,金属反应完,而小红取的酸量较少,酸完全反应完①金属活动性②相对原子质量.
(11)滤渣肯定有银,铜和过量的铁.加酸无气体则无过量铁,铁粉完全反应.铁粉首先和硝酸银反应得到硝酸亚铁和银.则溶液中肯定有硝酸亚铁.铁粉不与硝酸辛反应.则溶液中肯定有硝酸锌.由于铁粉完全反应,不知其用量.若与硝酸银完全反应.则溶液中无硝酸银.若铁粉很少量,硝酸银仍有可能存在.同理,硝酸铜也是.无法知道它是否存在.
故选Ag、Zn(NO3)2、Fe(NO3)2
(12)设该金属为X,相对分子量为x,化学方程式为
X+H2SO4═XSO4+H2↑
x 98
5-4.5 5×15%
由题意得 98:(5×15%)=x:(5-4.5)
解得 x=65 由此可知该金属为锌
由题意知,剩余固态物质3.2克为铜,则合金中铜的质量分数为(3.2÷5 )×100%=64%
故答案为:①64%②另一种金属为锌.
分析:化学的历史发展是一个漫长的过程,从古至今人们不断地从生活中积累经验,一步步加深对日常生活中常见金属的物理及化学性质的认识,并应用于生产生活中,在推动现代冶炼技术发展的同时,也促进了人类社会的进步.
(1)化学变化是某种物质除了形状、状态发生了变化,还有新物质生成的变化.选项A中石刀的制作仅仅是形状发生了变化,没有新物质生成不是化学变化.选项B中青铜的冶炼是把铜矿石与炭在高温的条件下提炼出铜的反应,有新物质生成属化学变化.选项C炼铁是将金属铁从含铁矿物(主要为铁的氧化物)中提炼出来的过程,发生了还原反应属化学变化.
(2)A.春秋时期,铁器在生产中广泛使用.B.青铜出现在夏朝.C.铝的冶炼只有100多年的历史.因此顺序为BAC.由题可知,活动性越强的金属,金属制品出现的越晚.
(3)金属的物理性质和化学性质;非金属的物理和化学性质.
(4)由题可知,绿色的孔雀石变成红色铜的过程中发生了两次化学反应,一是碱式碳酸铜经加热变成了黑色的氧化铜;二是氧化铜在森林大火中与碳反应变成了红色的铜.
(5)由题可知,主要成分中不含金元素,化学反应前后元素种类不可能发生变化,所以不能“炼石成金”.所谓的“黄金”是碳还原的铜锌的合金.
(6)由题可知,铁与铜的化合物反应,在溶液中把铜置换出来.
(7)由题可知,超导材料是由Y、Ba、Cu、O四种元素组成的.根据正、负化合价的代数和为零的原则.推出YmO2的化学式是Y3O2
碳酸钡在高温的条件下生成氧化钡和二氧化碳,因此该物质为二氧化碳.
(8)首先我们应该知道:生铁含碳量大于2.0%;钢含碳量小于2.0%.钢是由生铁再炼而成的,有较高的机械强度和韧性,具有耐热、耐腐蚀、耐磨等特殊性能.所以才有“恨铁不成钢”的谚语.
(9)根据反应速率越快,金属活动性越强的原则可知a的假设是错误的.而且反应速率与反应物的浓度有关.
(10)因为在金属活动顺序表中锌排在铁的前面,所以它的反应速率比铁快,因此小红的图象标反了.由图可知小刚的图是金属完全反应了,小红的图是酸完全反应了.
(11)将铁粉加到硝酸银、硝酸铜、硝酸锌的溶液中,铁能够置换出铜和银来,所以滤液中有硝酸锌.不能置换出锌来,故滤渣中有硝酸锌,又因加入盐酸后没有白色沉淀,所以滤渣中有银.
(12)由表格可知,前三次是同一种物质与硫酸完全反应,设该物质为X,写出化学方程式,根据消耗硫酸的质量确定金属的相对原子质量,然后推出该金属为锌.剩余固体物质为铜.
点评:本题主要是让我们结合生活常识和所学知识,探究日常生活中常见金属及其制品的物理和化学性质,涉及知识面比较广泛.
(1)青铜、铁都是金属,需要经过冶炼才能得到,冶炼就一定会涉及到化学反应.石刀是石头做的,石头在自然界都有,用石头制取石刀,只是物体形态发生变化而不会涉及到化学变化.故选A
(2)春秋时期,铁器在生产中广泛使用,青铜出现在夏朝.铝的冶炼只有100多年的历史,因此顺序为BAC.由题可知,活动性越强的金属,金属制品出现的越晚.金属制品的出现顺序与金属活性有关.故选B、A、C;金属活动性、C
(3)大多数金属都具有金属光泽,具有良好的延展性和导电、导热性,除汞外,金属在常温下都是固体.故答案为:金属光泽,良好的传热导电性,延展性易;失去电子
(4)由Cu2(OH)2CO3
 2CuO+H2O+CO2↑可得到氧化铜,氧化铜经过碳还原产生铜.故答案为:2CuO+C
2CuO+H2O+CO2↑可得到氧化铜,氧化铜经过碳还原产生铜.故答案为:2CuO+C 2Cu+CO2↑
2Cu+CO2↑(5)在化学变化过程中元素种类不可能发生变化,所谓的“金”不过是炉甘石、赤铜矿和碳在高温下还原反应产生的铜锌合金.故答案为:不能,在化学变化过程中元素种类不可能发生改变;铜锌合金;ZnCO3
 ZnO+CO2↑;2ZnO+C
ZnO+CO2↑;2ZnO+C 2Zn+CO2↑;2Cu2O+C
2Zn+CO2↑;2Cu2O+C 4Cu+CO2↑
4Cu+CO2↑(6)曾青主要成分是CuSO4、Cu(OH)2,易溶于苦酒(醋),又叫白青、空青.东汉时的《神农本草经》也有:“石胆…能化铁为铜”的话,石胆或胆矾,成分是含水硫酸铜CuSO45H2O.故答案为:Fe+CuSO4═Cu+FeSO4
(7)超导材料的化学式为Y2BaCu6O10,可知该材料有四种元素组成;根据正、负化合价的代数和为零的原则得出YmO2的化学式是Y3O2碳酸钡在高温的条件下生成氧化钡和二氧化碳,因此该物质为二氧化碳.故答案为:四;Y2O3;CO2;
(8)生铁含碳量大于2.0%;钢含碳量小于2.0%.钢是由生铁再炼而成的,有较高的机械强度和韧性,具有耐热、耐腐蚀、耐磨等特殊性能.故答案为:恨铁不成钢;C+O2
 CO2;含碳量不等
CO2;含碳量不等(9)根据反应速率越快,金属活动性越强的原则可知a的假设是错误的.而且反应速率与反应物的浓度有关.
故答案为:除去氧化膜利于直接反应;a;镁反应速率比钛快;否;反应速率与反应物浓度有关;
(10)金属与酸反应的速率与金属活性有关,金属与酸反应中若生成盐中金属价态相同,则生成的氢气量与相对原子量有关.故答案为:小红;图象中Fe与Zn标反了,Zn的反应速率较Fe快;小刚取的金属量较少,金属反应完,而小红取的酸量较少,酸完全反应完①金属活动性②相对原子质量.
(11)滤渣肯定有银,铜和过量的铁.加酸无气体则无过量铁,铁粉完全反应.铁粉首先和硝酸银反应得到硝酸亚铁和银.则溶液中肯定有硝酸亚铁.铁粉不与硝酸辛反应.则溶液中肯定有硝酸锌.由于铁粉完全反应,不知其用量.若与硝酸银完全反应.则溶液中无硝酸银.若铁粉很少量,硝酸银仍有可能存在.同理,硝酸铜也是.无法知道它是否存在.
故选Ag、Zn(NO3)2、Fe(NO3)2
(12)设该金属为X,相对分子量为x,化学方程式为
X+H2SO4═XSO4+H2↑
x 98
5-4.5 5×15%
由题意得 98:(5×15%)=x:(5-4.5)
解得 x=65 由此可知该金属为锌
由题意知,剩余固态物质3.2克为铜,则合金中铜的质量分数为(3.2÷5 )×100%=64%
故答案为:①64%②另一种金属为锌.
分析:化学的历史发展是一个漫长的过程,从古至今人们不断地从生活中积累经验,一步步加深对日常生活中常见金属的物理及化学性质的认识,并应用于生产生活中,在推动现代冶炼技术发展的同时,也促进了人类社会的进步.
(1)化学变化是某种物质除了形状、状态发生了变化,还有新物质生成的变化.选项A中石刀的制作仅仅是形状发生了变化,没有新物质生成不是化学变化.选项B中青铜的冶炼是把铜矿石与炭在高温的条件下提炼出铜的反应,有新物质生成属化学变化.选项C炼铁是将金属铁从含铁矿物(主要为铁的氧化物)中提炼出来的过程,发生了还原反应属化学变化.
(2)A.春秋时期,铁器在生产中广泛使用.B.青铜出现在夏朝.C.铝的冶炼只有100多年的历史.因此顺序为BAC.由题可知,活动性越强的金属,金属制品出现的越晚.
(3)金属的物理性质和化学性质;非金属的物理和化学性质.
(4)由题可知,绿色的孔雀石变成红色铜的过程中发生了两次化学反应,一是碱式碳酸铜经加热变成了黑色的氧化铜;二是氧化铜在森林大火中与碳反应变成了红色的铜.
(5)由题可知,主要成分中不含金元素,化学反应前后元素种类不可能发生变化,所以不能“炼石成金”.所谓的“黄金”是碳还原的铜锌的合金.
(6)由题可知,铁与铜的化合物反应,在溶液中把铜置换出来.
(7)由题可知,超导材料是由Y、Ba、Cu、O四种元素组成的.根据正、负化合价的代数和为零的原则.推出YmO2的化学式是Y3O2
碳酸钡在高温的条件下生成氧化钡和二氧化碳,因此该物质为二氧化碳.
(8)首先我们应该知道:生铁含碳量大于2.0%;钢含碳量小于2.0%.钢是由生铁再炼而成的,有较高的机械强度和韧性,具有耐热、耐腐蚀、耐磨等特殊性能.所以才有“恨铁不成钢”的谚语.
(9)根据反应速率越快,金属活动性越强的原则可知a的假设是错误的.而且反应速率与反应物的浓度有关.
(10)因为在金属活动顺序表中锌排在铁的前面,所以它的反应速率比铁快,因此小红的图象标反了.由图可知小刚的图是金属完全反应了,小红的图是酸完全反应了.
(11)将铁粉加到硝酸银、硝酸铜、硝酸锌的溶液中,铁能够置换出铜和银来,所以滤液中有硝酸锌.不能置换出锌来,故滤渣中有硝酸锌,又因加入盐酸后没有白色沉淀,所以滤渣中有银.
(12)由表格可知,前三次是同一种物质与硫酸完全反应,设该物质为X,写出化学方程式,根据消耗硫酸的质量确定金属的相对原子质量,然后推出该金属为锌.剩余固体物质为铜.
点评:本题主要是让我们结合生活常识和所学知识,探究日常生活中常见金属及其制品的物理和化学性质,涉及知识面比较广泛.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断变化.
(1)磁悬浮的核心技术得制备超导材料.有一种超导材料的化学式为Y2BaCu6O10,它是以Y2O3、BaCO3和CuO为原料经研磨烧结而成.假设此过程中所有元素的化合价不变,在合成该超导材料的同时还生成-种产物,该物质是 (写化学式).
(2)现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一种,现欲测定其组成.
[查阅资料]
Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn一119,Ni一59.
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
试求:
①合金中铜的质量分数.
②通过计算判断合金中另一金属为何种金属.
(1)磁悬浮的核心技术得制备超导材料.有一种超导材料的化学式为Y2BaCu6O10,它是以Y2O3、BaCO3和CuO为原料经研磨烧结而成.假设此过程中所有元素的化合价不变,在合成该超导材料的同时还生成-种产物,该物质是
(2)现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一种,现欲测定其组成.
[查阅资料]
Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn一119,Ni一59.
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
| 次 数 | l | 2 | 3 | 4 |
| 加入酸质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
①合金中铜的质量分数.
②通过计算判断合金中另一金属为何种金属.