题目内容
人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断变化.(1)磁悬浮的核心技术得制备超导材料.有一种超导材料的化学式为Y2BaCu6O10,它是以Y2O3、BaCO3和CuO为原料经研磨烧结而成.假设此过程中所有元素的化合价不变,在合成该超导材料的同时还生成-种产物,该物质是
(2)现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一种,现欲测定其组成.
[查阅资料]
Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn一119,Ni一59.
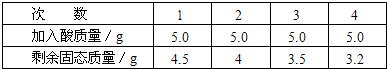
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
| 次 数 | l | 2 | 3 | 4 |
| 加入酸质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
①合金中铜的质量分数.
②通过计算判断合金中另一金属为何种金属.
分析:(1)由题可知,超导材料是由Y、Ba、Cu、O四种元素组成的.不含碳元素所以另一种产物中一定是含碳的化合物,已知碳酸钡在高温的条件下生成氧化钡和二氧化碳,因此该物质为二氧化碳.
(2)由表格可知,前三次是同一种物质与硫酸完全反应,设该物质为X,写出化学方程式,根据消耗硫酸的质量确定金属的相对原子质量,然后推出该金属为锌.剩余固体物质为铜.
(2)由表格可知,前三次是同一种物质与硫酸完全反应,设该物质为X,写出化学方程式,根据消耗硫酸的质量确定金属的相对原子质量,然后推出该金属为锌.剩余固体物质为铜.
解答:解:(1)超导材料的化学式为Y2BaCu6O10,可知该材料有四种元素组成;根据化学反应前后元素的种类不变可知另一种物质一定含碳,因为碳酸钡在高温的条件下生成氧化钡和二氧化碳,因此该物质为二氧化碳.
故答案为:CO2
(2)设该金属为X,相对分子量为x,化学方程式为
X+H2SO4═XSO4+H2↑
x 98
5-4.5 5×15%
由题意得
=
解得:x=65 由此可知该金属为锌
由题意知,由1、2、3实验可知每消耗5g酸液会消耗0.5g的金属,则可知第四次加入的酸没有完全反应,说明剩余固态物质3.2克为铜,
则合金中铜的质量分数为
×100%=64%
答:合金中铜的质量分数为64%;另一种金属是锌.
故答案为:CO2
(2)设该金属为X,相对分子量为x,化学方程式为
X+H2SO4═XSO4+H2↑
x 98
5-4.5 5×15%
由题意得
| x |
| 98 |
| 5-4.5 |
| 5×15% |
解得:x=65 由此可知该金属为锌
由题意知,由1、2、3实验可知每消耗5g酸液会消耗0.5g的金属,则可知第四次加入的酸没有完全反应,说明剩余固态物质3.2克为铜,
则合金中铜的质量分数为
| 3.2 |
| 5 |
答:合金中铜的质量分数为64%;另一种金属是锌.
点评:本题难度一般,但综合性强,以信息给予题的形式考查了金属的化学性质、质量守恒定律的应用等,完成此题可以依据已有的知识进行

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目