题目内容
人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断地发生变化,金属制品因其美观、耐用、轻便易成型而被人们广泛利用,请根据所学知识及生活知识参与有关金属及其制品的讨论.
(1)以下工具的制作过程中没有发生化学变化的是
A. 原始人制作石刀 B.冶炼青铜 C. 炼铁
(2)请将以下金属材料的冶炼按年代的先后顺序排序
A.铁 B.青铜 C.铝
(3)孔雀石主要成分为碱式碳酸铜,经加热会发生反应:Cu2(OH)2CO3
2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:
(4)到西汉时期我国的劳动人民又发明了“湿法炼铜”,在西汉刘安所著的《淮南万毕术》中就有“曾青得铁则化为铜”的记载(“曾青”是指铜的化合物),请用反应方程式表示其冶炼原理:
(5)现代工业冶炼金属铝和铁的化学反应方程式分别为:铝、
(6)某钢铁公司欲用200t含氧化铁80%的赤铁矿石炼铁,请你用两种不同的方法计算该公司所得到的生铁中最多含铁多少吨?
(1)以下工具的制作过程中没有发生化学变化的是
A
A
.A. 原始人制作石刀 B.冶炼青铜 C. 炼铁
(2)请将以下金属材料的冶炼按年代的先后顺序排序
B、A、C
B、A、C
(填序号).A.铁 B.青铜 C.铝
(3)孔雀石主要成分为碱式碳酸铜,经加热会发生反应:Cu2(OH)2CO3
| ||
2CuO+2C
2Cu+CO2↑
| ||
2CuO+2C
2Cu+CO2↑
| ||
(4)到西汉时期我国的劳动人民又发明了“湿法炼铜”,在西汉刘安所著的《淮南万毕术》中就有“曾青得铁则化为铜”的记载(“曾青”是指铜的化合物),请用反应方程式表示其冶炼原理:
Fe+CuSO4═Cu+FeSO4
Fe+CuSO4═Cu+FeSO4
.(5)现代工业冶炼金属铝和铁的化学反应方程式分别为:铝、
2Al2O3
4Al+3O2↑
| ||
2Al2O3
4Al+3O2↑
、铁、
| ||
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
| ||
(6)某钢铁公司欲用200t含氧化铁80%的赤铁矿石炼铁,请你用两种不同的方法计算该公司所得到的生铁中最多含铁多少吨?
分析:(1)依据各工具的制作过程分析解答;
(2)根据金属的冶炼年代的先后顺序分析解答;
(3)依据氧化铜与碳在加热时会生成铜分析解答;
(4)根据金属与盐溶液的反应原理分析解答;
(5)依据工业中铝、铁的冶炼原理书写方程式即可;
(6)根据化学方程式的计算以及化学式的计算分析解答即可;
(2)根据金属的冶炼年代的先后顺序分析解答;
(3)依据氧化铜与碳在加热时会生成铜分析解答;
(4)根据金属与盐溶液的反应原理分析解答;
(5)依据工业中铝、铁的冶炼原理书写方程式即可;
(6)根据化学方程式的计算以及化学式的计算分析解答即可;
解答:解:(1)各工具的制作过程中只有石刀的制作没有经过化学变化,只是经过了打磨的物理变化,而青铜器的冶炼、铁的冶炼都要经过化学变化;
(2)由所学的人类冶炼金属的历史依据三者的活动性知识可知铁、青铜和铝的冶炼顺序为:青铜、铁和铝;
(3)碱式碳酸铜分解可生成氧化铜而森林大火中一定会有木炭产生,而碳和氧化铜在加热时会生成铜和二氧化碳,方程式为2CuO+2C
2Cu+CO2↑;
(4)“湿法炼铜”的原理是金属与盐溶液的反应,可用Fe+CuSO4═Cu+FeSO4表示其反应的原理;
(5)工业中铝的冶炼一般是电解氧化铝而铁的冶炼原理则是氧化铁和一氧化碳的反应,方程式分别为:2Al2O3
4Al+3O2↑;Fe2O3+3CO
2Fe+3CO2;
(6)含铁量最多及铁没有损耗,所以可依据化学方程式以及化学式的计算解决;
解:①设可炼出的生铁最多含铁质量是x则
3CO+Fe2O3
2Fe+3CO2
160 112
200t×80% x
=
,
解得x=112t
②由于矿石中的铁元素的质量在反应后全部以单质铁存在,则根据铁元素的质量守恒可知,
炼出的生铁的含铁量最多为200t×80%×56
×100%=112t.
故答案为:(1)A;(2)B、A、C;(3)2CuO+2C
2Cu+CO2↑;(4)Fe+CuSO4═Cu+FeSO4;(5)2Al2O3
4Al+3O2↑; Fe2O3+3CO
2Fe+3CO2;
(6)答:该公司所得到的生铁中最多含铁112吨;
(2)由所学的人类冶炼金属的历史依据三者的活动性知识可知铁、青铜和铝的冶炼顺序为:青铜、铁和铝;
(3)碱式碳酸铜分解可生成氧化铜而森林大火中一定会有木炭产生,而碳和氧化铜在加热时会生成铜和二氧化碳,方程式为2CuO+2C
| ||
(4)“湿法炼铜”的原理是金属与盐溶液的反应,可用Fe+CuSO4═Cu+FeSO4表示其反应的原理;
(5)工业中铝的冶炼一般是电解氧化铝而铁的冶炼原理则是氧化铁和一氧化碳的反应,方程式分别为:2Al2O3
| ||
| ||
(6)含铁量最多及铁没有损耗,所以可依据化学方程式以及化学式的计算解决;
解:①设可炼出的生铁最多含铁质量是x则
3CO+Fe2O3
| ||
160 112
200t×80% x
| 160 |
| 112 |
| 200t×80% |
| x |
解得x=112t
②由于矿石中的铁元素的质量在反应后全部以单质铁存在,则根据铁元素的质量守恒可知,
炼出的生铁的含铁量最多为200t×80%×56
| 56×2 |
| 56×2+16×3 |
故答案为:(1)A;(2)B、A、C;(3)2CuO+2C
| ||
| ||
| ||
(6)答:该公司所得到的生铁中最多含铁112吨;
点评:此题是有关金属知识的考查题,知识点较多但基础性较强,属于难度较小的基础性考查题;

练习册系列答案
相关题目
人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断变化.
(1)磁悬浮的核心技术得制备超导材料.有一种超导材料的化学式为Y2BaCu6O10,它是以Y2O3、BaCO3和CuO为原料经研磨烧结而成.假设此过程中所有元素的化合价不变,在合成该超导材料的同时还生成-种产物,该物质是 (写化学式).
(2)现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一种,现欲测定其组成.
[查阅资料]
Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn一119,Ni一59.
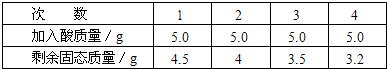
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
试求:
①合金中铜的质量分数.
②通过计算判断合金中另一金属为何种金属.
(1)磁悬浮的核心技术得制备超导材料.有一种超导材料的化学式为Y2BaCu6O10,它是以Y2O3、BaCO3和CuO为原料经研磨烧结而成.假设此过程中所有元素的化合价不变,在合成该超导材料的同时还生成-种产物,该物质是
(2)现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一种,现欲测定其组成.
[查阅资料]
Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn一119,Ni一59.
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
| 次 数 | l | 2 | 3 | 4 |
| 加入酸质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
①合金中铜的质量分数.
②通过计算判断合金中另一金属为何种金属.