题目内容
(1)根据如图几种粒子的结构示意图,回答问题:
其中属于阴离子的是 .(填编号.下同)属于金属元素的是 .具有相似化学性质的粒子有 .易失电子的元素是 相对稳定结构的是 .
(2)只用Ca、C、O、Cl、H五种元素的一种或几种,按要求填空:各写出一个化学式:①氧化物 ②酸 ③碱 ④盐 .
(3)各写出一个化学方程式:①分解反应 ;②复分解反应 .
【答案】分析:(1)依据阴离子是核外电子数大于核内质子数的粒子,金属元素最外层电子数一般小于4,具有相似化学性质的微粒则其最外层电子数相同,易失电子的元素是最外层电子数小于4的微粒,稳定结构是最外层电子数为8(一层时其电子数是2)的微粒,据此分析解答;
(2)依据氧化物酸碱盐的定义结合元素的种类分析解答即可;
(3)依据分解反应与复分解反应的特点书写对应的方程式即可;
解答:解:(1)ABCD4种微粒中ABD质子数等于电子数,所以是原子,阴离子是核外电子数大于核内质子数的粒子,故B属于阴离子;金属元素最外层电子数一般小于4,故D属于金属元素(B的原子最外层电子数是6);具有相似化学性质的微粒则其最外层电子数相同,故AC化学性质相似;化学反应中易失电子的元素是最外层电子数小于4的微粒,故D易失电子;稳定结构是最外层电子数为8(一层时其电子数是2)的微粒,故B属于稳定结构;
(2)氧化物具有两种元素,且其中一种是氧元素,所以可以是CO;酸在电离时生成的阳离子全部是氢离子,故H2CO3属于酸;碱在电离时生成的阴离子全部是氢氧根离子,故Ca(OH)2属于碱;盐是金属离子和酸根离子组成的化合物,故CaCl2属于盐类;
(3)①分解反应是一种物质发生反应生成多种物质的化学变化,故2H2O 2H2↑+O2↑属于分解反应;复分解反应是两种化合物相互交换成分生成两种新的化合物的反应,故NaOH+HCl=NaCl+H2O属于复分解反应;
2H2↑+O2↑属于分解反应;复分解反应是两种化合物相互交换成分生成两种新的化合物的反应,故NaOH+HCl=NaCl+H2O属于复分解反应;
故答案为:(1)B;D;AC;D;B;(2)①CO;②H2CO3;③Ca(OH)2;④CaCl2;(3)①2H2O 2H2↑+O2↑;NaOH+HCl=NaCl+H2O;
2H2↑+O2↑;NaOH+HCl=NaCl+H2O;
点评:此题是对粒子结构示意图以及化学用语的有关知识的考查,属常规性基础知识的巩固练习;
(2)依据氧化物酸碱盐的定义结合元素的种类分析解答即可;
(3)依据分解反应与复分解反应的特点书写对应的方程式即可;
解答:解:(1)ABCD4种微粒中ABD质子数等于电子数,所以是原子,阴离子是核外电子数大于核内质子数的粒子,故B属于阴离子;金属元素最外层电子数一般小于4,故D属于金属元素(B的原子最外层电子数是6);具有相似化学性质的微粒则其最外层电子数相同,故AC化学性质相似;化学反应中易失电子的元素是最外层电子数小于4的微粒,故D易失电子;稳定结构是最外层电子数为8(一层时其电子数是2)的微粒,故B属于稳定结构;
(2)氧化物具有两种元素,且其中一种是氧元素,所以可以是CO;酸在电离时生成的阳离子全部是氢离子,故H2CO3属于酸;碱在电离时生成的阴离子全部是氢氧根离子,故Ca(OH)2属于碱;盐是金属离子和酸根离子组成的化合物,故CaCl2属于盐类;
(3)①分解反应是一种物质发生反应生成多种物质的化学变化,故2H2O
 2H2↑+O2↑属于分解反应;复分解反应是两种化合物相互交换成分生成两种新的化合物的反应,故NaOH+HCl=NaCl+H2O属于复分解反应;
2H2↑+O2↑属于分解反应;复分解反应是两种化合物相互交换成分生成两种新的化合物的反应,故NaOH+HCl=NaCl+H2O属于复分解反应;故答案为:(1)B;D;AC;D;B;(2)①CO;②H2CO3;③Ca(OH)2;④CaCl2;(3)①2H2O
 2H2↑+O2↑;NaOH+HCl=NaCl+H2O;
2H2↑+O2↑;NaOH+HCl=NaCl+H2O;点评:此题是对粒子结构示意图以及化学用语的有关知识的考查,属常规性基础知识的巩固练习;

练习册系列答案
相关题目
如图是实验室常用的几种装置和仪器,根据所学知识回答下列问题.
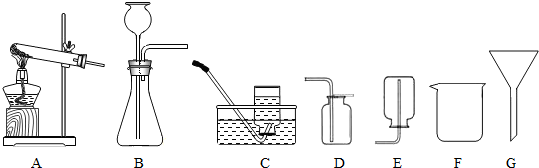
(1)写出仪器G的名称 .
(2)实验室用高锰酸钾加热制取并收集氧气的装置可选择 (填编号,下同),反应的化学方程式为 .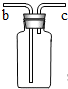
(3)实验室用锌粒与稀硫酸反应制取并收集氢气的装置可选择 .
(4)小丽同学欲收集一种难溶于水的气体,认为右图装置可以代替C装置,请简述小丽同学应如何使用该装置?
.
(5)实验室用石灰石和稀盐酸反应制取并收集二氧化碳应选用上图中的组合为 .
请设计一个实验,证明在常温常压下,二氧化碳气体能溶于水,并填写下列实验报告.

(1)写出仪器G的名称
(2)实验室用高锰酸钾加热制取并收集氧气的装置可选择

(3)实验室用锌粒与稀硫酸反应制取并收集氢气的装置可选择
(4)小丽同学欲收集一种难溶于水的气体,认为右图装置可以代替C装置,请简述小丽同学应如何使用该装置?
(5)实验室用石灰石和稀盐酸反应制取并收集二氧化碳应选用上图中的组合为
请设计一个实验,证明在常温常压下,二氧化碳气体能溶于水,并填写下列实验报告.
| 实验步骤 | 实验现象 | 结论 |
| 在常温常压下二氧化碳气体能溶于水 |
 以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:
以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:
| 试管编号 | 加入液体 | 加入物质 | 现象 |
| 1 | 10mL水 | 少量食盐 | 不溶 |
| 2 | 10mL乙醇 | 少量食盐 | 溶解 |
| 3 | 10mL水 | 几小粒碘 | 不溶 |
| 4 | 10mL乙醇 | 几小粒碘 | 溶解 |
(2)除(1)中的因素外,你认为固体物质的溶解能力还与外界条件______有关.
如果外界条件和溶剂的种类确定,要比较硝酸钾和氯化钠的溶解能力,实验中需要控制的因素是______.
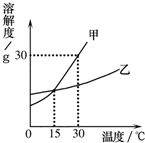
(3)根据如图甲、乙两种固体物质的溶解度曲线,你能获得的信息是______、______(答两条).
 (2006?淄博)以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:
(2006?淄博)以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答: