题目内容
27、实验室里有一瓶标签残缺的盐酸,请你参与下列有关问题的研讨.
(1)怎样立即确定该瓶盐酸是浓盐酸?有人猜测是,有人记得好象不是,大家各抒已见,你认为,应该用下列中的
A、讨论 B、调查 C、实验 D、上网
具体做法是
(2)某同学想粗略测定该盐酸每亳升中含溶质HCl的质量,他依据酸和碱中和反应的原理,设计了一种实验方案,其操作步骤如下:
第一步,在小烧杯中加入10g5%的NaOH溶液; 第二步,向上述烧杯中滴入2滴酚酞试液;
第三步,向10mL的量筒里注入该盐酸至一定刻度;
条四步,用胶头滴管吸取量筒中的盐酸,逐滴滴入上述烧杯中,滴到溶液由红色刚刚变为无色为止,将胶头滴管中的剩余液体全部滴入量筒中;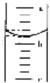
第五步,记录实验数据;
第六步,计算确定每毫升盐酸中含溶质HCl的质量.
请根据以上实验过程,回答下列问题:
①本实验为什么要用指示剂(酚酞)?答:
②第三步中向量筒注入盐酸,量筒中液面的位置如图所示,a与b、b与c刻度间均相差1mL,如果刻度a为4,量筒中盐酸的体积是
③第四步要用到玻璃棒,它的用途是
④第五步要记录的数据是
(3)实验结束后有的同学认为,在(2)中测定每毫升盐酸中含溶质HCl的质量的原理和方法还有多种.请你利用所学的化学知识再写出几种其他方案(用文字简述所依据的原理和要测定的数据,不需要写化学方程式).
方法一:
方法二:
方法三:
(1)怎样立即确定该瓶盐酸是浓盐酸?有人猜测是,有人记得好象不是,大家各抒已见,你认为,应该用下列中的
C
方法;(填编号)A、讨论 B、调查 C、实验 D、上网
具体做法是
打开瓶盖,观察瓶口上方是否有白雾出现
.(2)某同学想粗略测定该盐酸每亳升中含溶质HCl的质量,他依据酸和碱中和反应的原理,设计了一种实验方案,其操作步骤如下:
第一步,在小烧杯中加入10g5%的NaOH溶液; 第二步,向上述烧杯中滴入2滴酚酞试液;
第三步,向10mL的量筒里注入该盐酸至一定刻度;
条四步,用胶头滴管吸取量筒中的盐酸,逐滴滴入上述烧杯中,滴到溶液由红色刚刚变为无色为止,将胶头滴管中的剩余液体全部滴入量筒中;

第五步,记录实验数据;
第六步,计算确定每毫升盐酸中含溶质HCl的质量.
请根据以上实验过程,回答下列问题:
①本实验为什么要用指示剂(酚酞)?答:
用指示剂可以确定盐酸滴加到什么时候氢氧化钠与盐酸恰好完全反应.
;②第三步中向量筒注入盐酸,量筒中液面的位置如图所示,a与b、b与c刻度间均相差1mL,如果刻度a为4,量筒中盐酸的体积是
3.2ml
;③第四步要用到玻璃棒,它的用途是
搅拌
,目的是让盐酸和氢氧化钠充分接触,使其反应完全.
;④第五步要记录的数据是
量筒中剩余盐酸的量
;(3)实验结束后有的同学认为,在(2)中测定每毫升盐酸中含溶质HCl的质量的原理和方法还有多种.请你利用所学的化学知识再写出几种其他方案(用文字简述所依据的原理和要测定的数据,不需要写化学方程式).
方法一:
称量一个小烧杯的质量,向该烧杯中加入一定量的盐酸,再加入一定量的过量的锌粒,待无气泡冒出后,称量装置的总质量.反
应前后装置减少的质量为氢气的质量,根据氢气的质量可求出所加盐酸中溶质的质量
;方法二:
向烧杯中加入一定量的的盐酸,再加入一定量的过量的氧化铜,待充分反应后,过滤、洗涤、干燥并称量剩余氧化铜的质量,根
据参加反应的氧化铜的质量可求出所加盐酸中溶质的质量
;方法三:
称量一个小烧杯的质量,向该烧杯中加入一定量的盐酸,再加入一定量的过量的大理石,待无气泡冒出后,称量装置的总质量.
反应前后装置减少的质量为二氧化碳的质量,根据二氧化碳的质量可求出所加盐酸中溶质的质量
.分析:(1)化学是一门以实验为基础的学科,通过实验得到的结论才可靠.判断一瓶盐酸是否为浓盐酸最简便的办法是根据盐酸的挥发性来确定.
(2)①盐酸与氢氧化钠反应无明显现象,若不用指示剂的话,将不知道什么时候恰好完全反应.
②先确定b处的刻度和量筒的分度值再读数,读数时视线要与量筒内液体的凹液面的最低处保持水平.
③若不搅拌,盐酸与氢氧化钠混合不均匀,不能充分反应.
④要确定每毫升盐酸中含溶质HCl的质量,所用盐酸中溶质的质量根据氢氧化钠的质量可以算出,所用盐酸溶液的量不知道,可用所取盐酸的量-剩余盐酸的量得到,所以这里记录的是剩余盐酸的量.
(3)根据酸的通性,酸除了能与碱反应外还能与酸碱指示剂、活泼金属、金属氧化物、盐反应.涉及有关酸的质量的计算,可从酸与活泼金属反应、酸与金属氧化物反应、酸与盐的反应来考虑.
(2)①盐酸与氢氧化钠反应无明显现象,若不用指示剂的话,将不知道什么时候恰好完全反应.
②先确定b处的刻度和量筒的分度值再读数,读数时视线要与量筒内液体的凹液面的最低处保持水平.
③若不搅拌,盐酸与氢氧化钠混合不均匀,不能充分反应.
④要确定每毫升盐酸中含溶质HCl的质量,所用盐酸中溶质的质量根据氢氧化钠的质量可以算出,所用盐酸溶液的量不知道,可用所取盐酸的量-剩余盐酸的量得到,所以这里记录的是剩余盐酸的量.
(3)根据酸的通性,酸除了能与碱反应外还能与酸碱指示剂、活泼金属、金属氧化物、盐反应.涉及有关酸的质量的计算,可从酸与活泼金属反应、酸与金属氧化物反应、酸与盐的反应来考虑.
解答:解:(1)要确定该瓶盐酸为浓盐酸,通过讨论、调查、上网的方法都不可行,只有通过实验才能得到结论.若是浓盐酸的话,打开瓶盖,从浓盐酸中挥发出的氯化氢气体与空气中的水蒸汽结合形成盐酸小液滴,在瓶口上方会看到有白雾出现.故答案为:C;打开瓶盖,看瓶口上方是否有白雾出现.
(2)①向氢氧化钠溶液中滴加酚酞试液,溶液变为红色,再向该溶液中滴加盐酸,当溶液由红色恰好变为无色时,溶液显中性,此时氢氧化钠与盐酸恰好完全反应.故答案为:用指示剂可以确定盐酸滴加到什么时候氢氧化钠与盐酸恰好完全反应.
②a处的刻度为4,则b处的刻度为3,该量筒的分度值为0.2 ml,量筒内液体凹液面的最低处在3.2ml处,故答案为:3.2ml
③用玻璃棒搅拌可以让盐酸与氢氧化钠混合均匀,使其充分反应.故答案为:搅拌 让盐酸和氢氧化钠充分接触,使其反应完全.④这里记录的是量筒中剩余盐酸的量,从而确定所用盐酸的量.
故答案为:量筒中剩余盐酸的量
(3)一定量的酸与足量的活泼金属反应,根据生成氢气的质量或参加反应的金属的质量可算出酸溶液中溶质的质量.
一定量的酸与足量的金属氧化物反应,根据参加反应的金属氧化物的质量可算出酸溶液中溶质的质量.
一定量的酸与足量的碳酸盐反应,根据生成的二氧化碳的质量或参加反应的碳酸盐的质量可求出酸溶液中溶质的质量.
故答案为:称量一个小烧杯的质量,向该烧杯中加入一定量的盐酸,再加入一定量的过量的锌粒,待无气泡冒出后,称量装置的总质量.反应前后装置减少的质量为氢气的质量,根据氢气的质量可求出所加盐酸中溶质的质量.
向烧杯中加入一定量的的盐酸,再加入一定量的过量的氧化铜,待充分反应后,过滤、洗涤、干燥并称量剩余氧化铜的质量,根据参加反应的氧化铜的质量可求出所加盐酸中溶质的质量.
称量一个小烧杯的质量,向该烧杯中加入一定量的盐酸,再加入一定量的过量的大理石,待无气泡冒出后,称量装置的总质量.反应前后装置减少的质量为二氧化碳的质量,根据二氧化碳的质量可求出所加盐酸中溶质的质量.
(2)①向氢氧化钠溶液中滴加酚酞试液,溶液变为红色,再向该溶液中滴加盐酸,当溶液由红色恰好变为无色时,溶液显中性,此时氢氧化钠与盐酸恰好完全反应.故答案为:用指示剂可以确定盐酸滴加到什么时候氢氧化钠与盐酸恰好完全反应.
②a处的刻度为4,则b处的刻度为3,该量筒的分度值为0.2 ml,量筒内液体凹液面的最低处在3.2ml处,故答案为:3.2ml
③用玻璃棒搅拌可以让盐酸与氢氧化钠混合均匀,使其充分反应.故答案为:搅拌 让盐酸和氢氧化钠充分接触,使其反应完全.④这里记录的是量筒中剩余盐酸的量,从而确定所用盐酸的量.
故答案为:量筒中剩余盐酸的量
(3)一定量的酸与足量的活泼金属反应,根据生成氢气的质量或参加反应的金属的质量可算出酸溶液中溶质的质量.
一定量的酸与足量的金属氧化物反应,根据参加反应的金属氧化物的质量可算出酸溶液中溶质的质量.
一定量的酸与足量的碳酸盐反应,根据生成的二氧化碳的质量或参加反应的碳酸盐的质量可求出酸溶液中溶质的质量.
故答案为:称量一个小烧杯的质量,向该烧杯中加入一定量的盐酸,再加入一定量的过量的锌粒,待无气泡冒出后,称量装置的总质量.反应前后装置减少的质量为氢气的质量,根据氢气的质量可求出所加盐酸中溶质的质量.
向烧杯中加入一定量的的盐酸,再加入一定量的过量的氧化铜,待充分反应后,过滤、洗涤、干燥并称量剩余氧化铜的质量,根据参加反应的氧化铜的质量可求出所加盐酸中溶质的质量.
称量一个小烧杯的质量,向该烧杯中加入一定量的盐酸,再加入一定量的过量的大理石,待无气泡冒出后,称量装置的总质量.反应前后装置减少的质量为二氧化碳的质量,根据二氧化碳的质量可求出所加盐酸中溶质的质量.
点评:第三小题测定每毫升盐酸中溶质的质量的实验中,向盐酸中所加的和盐酸反应的物质一定要足量,要确保盐酸反应完,否则会造成测量值偏小.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
 实验室里有一瓶标签残缺的盐酸,请你来探究:
实验室里有一瓶标签残缺的盐酸,请你来探究: