题目内容
(1)如图1,A、B、C三个实验用于验证质量守恒定律:
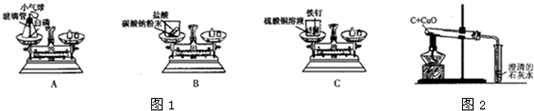
①实验C中,烧杯中看到的现象是
②其中不能达到实验目的是
(2)如图2是“用木碳还原氧化铜”的演示实验,请回答下列问题:
①写出用木碳还原氧化铜的化学方程式:
②反应进行一段时间后,为了探究试管中剩余固体的组成,待试管冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,充分搅拌后过滤.
a.若滤纸上留有黑色、红色固体,而滤液为无色,则滤液中的溶质是
b.若滤纸上留有黑色、红色固体,而滤液呈蓝色,此时滤液中的溶质是
(3)如图是探究酸碱中和的实验:
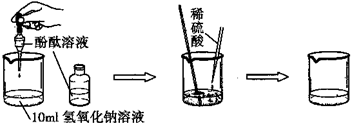
小丽同学为探究上述反应后烧杯中的硫酸是否过量,选取BaCl2、锌粒、紫色石蕊等三种药品和试剂来设计实验,请你根据下表判断出正确的实验方案及分析错误方案的出错原因:
①设计的三个方案中,正确的方案是:
②请分析错误方案的原因:

①实验C中,烧杯中看到的现象是
铁钉表面变成红色
铁钉表面变成红色
;②其中不能达到实验目的是
B
B
,理由是生成的二氧化碳气体逸散到空气中去了
生成的二氧化碳气体逸散到空气中去了
.(2)如图2是“用木碳还原氧化铜”的演示实验,请回答下列问题:
①写出用木碳还原氧化铜的化学方程式:
C+2CuO
2Cu+CO2↑
| ||
C+2CuO
2Cu+CO2↑
;
| ||
②反应进行一段时间后,为了探究试管中剩余固体的组成,待试管冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,充分搅拌后过滤.
a.若滤纸上留有黑色、红色固体,而滤液为无色,则滤液中的溶质是
H2SO4
H2SO4
,说明试管中的剩余固体为木炭、Cu
木炭、Cu
;b.若滤纸上留有黑色、红色固体,而滤液呈蓝色,此时滤液中的溶质是
CuSO4、H2SO4
CuSO4、H2SO4
.(3)如图是探究酸碱中和的实验:

小丽同学为探究上述反应后烧杯中的硫酸是否过量,选取BaCl2、锌粒、紫色石蕊等三种药品和试剂来设计实验,请你根据下表判断出正确的实验方案及分析错误方案的出错原因:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,放入几粒锌粒 | 溶液中产生气泡 | 硫酸过量 |
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
方案二和方案三
方案二和方案三
;②请分析错误方案的原因:
溶液中有生成的硫酸钠,加入氯化钡溶液即使硫酸不过量同样产生白色沉淀
溶液中有生成的硫酸钠,加入氯化钡溶液即使硫酸不过量同样产生白色沉淀
.分析:(1)①根据铁置换硫酸铜的现象分析;
②做验证质量守恒定律的实验时所选用的装置应该考虑到:如果反应物中有气体参加反应,或生成物中有气体生成,应该选用密闭装置;如果反应物中没有气体参加生成物中也没有气体生成,装置可不考虑密闭.
(2)根据木炭还原氧化铜的原理写出化学方程式,试管中剩余固体根据加入稀硫酸后的现象判断,碳、氧化铜都是黑色,而氧化铜能与稀硫酸反应,碳不与稀硫酸反应,试管中一定含有生成的固体铜.
(3)根据生成的硫酸钠也与氯化钡反应生成硫酸钡沉淀和锌粒能与酸反应生成氢气、石蕊试液遇酸变红色填写.
②做验证质量守恒定律的实验时所选用的装置应该考虑到:如果反应物中有气体参加反应,或生成物中有气体生成,应该选用密闭装置;如果反应物中没有气体参加生成物中也没有气体生成,装置可不考虑密闭.
(2)根据木炭还原氧化铜的原理写出化学方程式,试管中剩余固体根据加入稀硫酸后的现象判断,碳、氧化铜都是黑色,而氧化铜能与稀硫酸反应,碳不与稀硫酸反应,试管中一定含有生成的固体铜.
(3)根据生成的硫酸钠也与氯化钡反应生成硫酸钡沉淀和锌粒能与酸反应生成氢气、石蕊试液遇酸变红色填写.
解答:解:(1)①铁能置换出硫酸铜中的铜,因此实验C中,烧杯中看到的现象是铁钉表面变成红色;
故答案为:铁钉表面变成红色;
②用图A中的装置进行验证质量守恒定律,能达到目的,原因在于装置是密封的;
图B不能达到目的,因为生成的二氧化碳气体逸散到空气中去了;
图C也能达到目的,因为生成物和反应物中都没有气体产生;
故答案为:B; 生成的二氧化碳气体逸散到空气中去了;
(2)①木炭与氧化铜在高温下反应生成铜和二氧化碳,化学方程式为:C+2CuO
2Cu+CO2↑;
②a、铜、碳和稀硫酸不反应,氧化铜与稀硫酸反应,滤纸上留有黑色、红色固体,滤液为无色,说明剩余固体中没有氧化铜,黑色固体一定是木炭,加入稀硫酸没有参加反应,故滤液中溶质为硫酸,试管中的剩余固体为木炭.
b、若滤纸上有黑色、红色固体,而滤液呈蓝色,说明氧化铜与木炭都剩余,此时滤液中的溶质一定含有硫酸与氧化铜反应生成的硫酸铜,而硫酸是过量的,所以溶质还有硫酸.
故答案为:①C+2CuO
2Cu+CO2↑;②a、H2SO4;木炭、Cu;b、CuSO4、H2SO4;
(3)因为方案一即使硫酸不过量,氢氧化钠和硫酸生成的硫酸钠也与氯化钡反应生成硫酸钡沉淀,而活泼金属锌能与酸反应生成氢气、石蕊试液遇酸变红色,所以方案二、三正确;
故答案为:①方案二和方案三;②溶液中有生成的硫酸钠,加入氯化钡溶液即使硫酸不过量同样产生白色沉淀.
故答案为:铁钉表面变成红色;
②用图A中的装置进行验证质量守恒定律,能达到目的,原因在于装置是密封的;
图B不能达到目的,因为生成的二氧化碳气体逸散到空气中去了;
图C也能达到目的,因为生成物和反应物中都没有气体产生;
故答案为:B; 生成的二氧化碳气体逸散到空气中去了;
(2)①木炭与氧化铜在高温下反应生成铜和二氧化碳,化学方程式为:C+2CuO
| ||
②a、铜、碳和稀硫酸不反应,氧化铜与稀硫酸反应,滤纸上留有黑色、红色固体,滤液为无色,说明剩余固体中没有氧化铜,黑色固体一定是木炭,加入稀硫酸没有参加反应,故滤液中溶质为硫酸,试管中的剩余固体为木炭.
b、若滤纸上有黑色、红色固体,而滤液呈蓝色,说明氧化铜与木炭都剩余,此时滤液中的溶质一定含有硫酸与氧化铜反应生成的硫酸铜,而硫酸是过量的,所以溶质还有硫酸.
故答案为:①C+2CuO
| ||
(3)因为方案一即使硫酸不过量,氢氧化钠和硫酸生成的硫酸钠也与氯化钡反应生成硫酸钡沉淀,而活泼金属锌能与酸反应生成氢气、石蕊试液遇酸变红色,所以方案二、三正确;
故答案为:①方案二和方案三;②溶液中有生成的硫酸钠,加入氯化钡溶液即使硫酸不过量同样产生白色沉淀.
点评:本题考查了质量守恒定律、碳还原氧化铜以及酸碱中和等化学知识,在做这种类型题目时,要求学生要注意总结规律,这样学习化学,可以达到事半功倍的效果,长此以往,同学们的学习能力便会在潜移默化中得到提高.

练习册系列答案
相关题目

 (2006?顺义区二模)如图1是a、b、c三种固体物质的溶解度曲线,根据曲线回答下列问题:
(2006?顺义区二模)如图1是a、b、c三种固体物质的溶解度曲线,根据曲线回答下列问题:
 --氢原子
--氢原子 --氧原子
--氧原子 --硫原子
--硫原子



 ”微粒.
”微粒.



