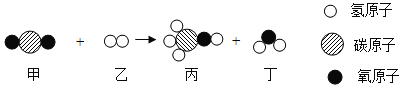
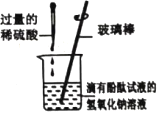
题目内容
【题目】某沿海工业区排放的污水中含有少量的 Fe2+、Na+、Ca2+、Cu2+、Cl-,为了达到零污染的目标,将污水进行如下工业流程处理(已知:氢氧化亚铁是一种白色絮状沉淀物)
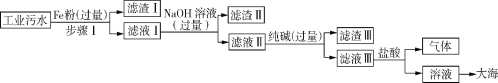
(1)步骤Ⅰ的操作名称是___________,写出步骤Ⅰ中的化学方程式:___________。
(2)滤渣Ⅰ所含的物质是________________(填化学式)。
(3)在滤液Ⅲ中加入盐酸使得到的溶液呈中性,要使用_______________来测定溶液的酸碱度,确保盐酸不过量。
【答案】过滤 ![]() Fe、Cu pH试纸
Fe、Cu pH试纸
【解析】
过滤是分离固体和液体的方法,应用金属活动顺序及反应物过量的问题,及测定溶液pH的方法来分析作答。
(1)经过步骤Ⅰ后得到的是滤渣和滤液,所以分离难溶性固体和液体应该采用的方法是过滤;废液中含有Fe2+、Na+、Ca2+、Cu2+、Cl-,在金属活动顺序中,Ca>Na>Fe>Cu,铁不能置换Na+、Ca2+,铁的活动性大于铜,所以铁可以置换出氯化铜中的铜,同时生成氯化亚铁,反应为:![]() ;
;
(2)因为在步骤Ⅰ中加入的铁粉是过量的,所以滤渣Ⅰ是置换出来的铜与剩余的铁的混合物;
(3)测定溶液的酸碱度,也就是pH,通常用pH试纸。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】某兴趣小组在实验室中探究氢氧化钠的性质,请你参与探究并填空
(实验过程与分析)
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
实验现象 | _____ | _____ | 溶液由红色变为无色 |
实验分析 |
|
| 该中和反应实质是_____ |
实验结论 | _____ | _____ | 氢氧化钠能与硫酸发生反应 |
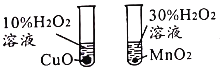
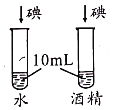
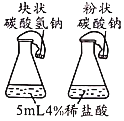
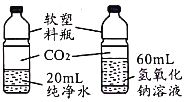
【题目】控制变量是实验探究的重要方法。下列实验设计能达到实验目的的是![]()
|
|
|
|
A.探究催化剂的种类对反应速率的影响 | B.探究不同溶剂中物质溶解性大小 | C.比较物质与稀盐酸反应的快慢 | D.证明二氧化碳和氢氧化钠发生了反应 |
A.AB.BC.CD.D