题目内容
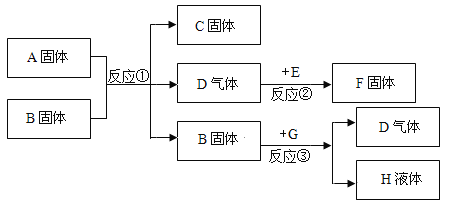
【题目】甲、乙、丙为初中化学常见的物质,且都含同一种元素,它们转化关系如图,其它部分反应物、生成物及条件已略去。

(1)若甲为黑色单质,乙、丙是氧化物,且组成元素相同,则甲的化学式为__________,写出步骤③反应的化学方程式________________。
(2)若甲为H2O2,则丙的化学式可能为___________。
【答案】C ![]()
![]()
【解析】
甲为黑色单质,乙、丙是氧化物,且组成元素相同,则是碳、二氧化碳和一氧化碳之间的转化;甲为![]() ,则是过氧化氢、水以及氢气之间的转化。
,则是过氧化氢、水以及氢气之间的转化。
(1)甲为黑色单质,乙、丙是氧化物,且组成元素相同,则甲是碳,丙能与氧化铜反应,故丙是一氧化碳,乙是二氧化碳,故填:C;![]() ;
;
(2)甲为![]() ,则生成的乙是水或是氧气,由于丙能与氧化铜加热生成乙,故乙是水,丙是氢气,故填:
,则生成的乙是水或是氧气,由于丙能与氧化铜加热生成乙,故乙是水,丙是氢气,故填:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】中和反应在日常生活中应用广泛,下列是稀盐酸和氢氧化钠溶液反应的微观示意图。请回答以下问题:
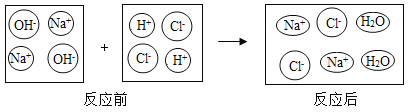
(1)分析图中反应前后没有发生变化的微粒是________、________;反应的实质是________。
(2)如果测定上述反应后溶液的![]() ,显酸性。请你设计一个实验方案证明溶液显酸性:
,显酸性。请你设计一个实验方案证明溶液显酸性:
实验操作 | 实验现象 | 实验结论 |
①_______ | ②________ | ③________ |
【题目】学习了MnO2对过氧化氢分解有催化作用的知识后.某同学想:CuO(氧化铜)能否起到类似MnO2的催化剂作用呢?于是进行了以下探究.
(猜想)Ⅰ.CuO不是催化剂,也不参与反应,反应前后质量和化学性质不变;
Ⅱ.CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ.CuO是反应的催化剂,反应前后质量和化学性质没有发生改变
(查阅资料)1、很多金属氧化物能做过氧化氢的催化剂,例如:MnO2、CuO、氧化铁(Fe2O3)等。
2、过氧化氢有很强的氧化性,能使有色布条褪色,能使铁等金属生锈(铁锈的主要成分是氧化铁),能用于伤口杀菌消毒等。
(实验)用天平称量0.2g CuO,取5mL5%的过氧化氢溶液于试管中,进行如下实验:

(1)填写下表:
实验步骤3现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
_____,带火星的木条复燃. | _____ | 溶液中有气泡放出, __________ | 猜想Ⅰ、Ⅱ不成立;猜想Ⅲ成立 |
(2)步骤1的目的是_____;
(3)步骤④需用到的玻璃仪器有:_____;
(4)过氧化氢能被CuO催化分解放出O2的文字表达式为_____。
(反思)
(5)同学通过实验验证了CuO能做过氧化氢分解的催化剂,另一同学将一根洁净的铁丝放入过氧化氢溶液中开始没有明显现象,过一会发现有大量气泡产生。产生这一现象的原因可能是_____,
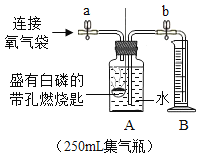
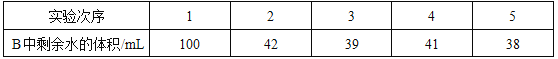
(6)某同学利用下图装置验证空气中氧气的体积分数,将装有足量红磷的燃烧匙置于瓶内中间,并把装有足量白磷的燃烧匙浸没在蒸馏水下。图乙表示用氧气传感器测量的容器内氧气浓度变化曲线图。

(提出问题)红磷在烧瓶内熄灭后,瓶中是否有氧气剩余?
(猜想假设)猜想:①有氧气剩余;②无氧气剩余。
(实验验证)待装置完全冷却后,将装有白磷的燃烧匙提出水面,用激光笔点燃白磷。
(得出结论)分析图乙得出,猜想②正确
(反思交流)①根据本实验的结论,教材中用“燃烧红磷测定空气中氧气含量”的方法是否可行并说明理由_____。
②曲线DE段氧气浓度变化的主要原因是_____。
③丙图利用铁粉除去氧气较彻底最后生成了氢氧化亚铁。请写出文字表达式_____。