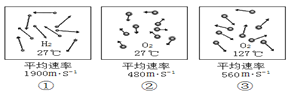
题目内容
【题目】写出符合下列要求的化学反应的文字(或符号)表达式,并将它们按反应类型进行分类。
(1)生成有刺激性气味气体的燃烧反应:_____。
(2)实验室在常温下制取氧气的反应:_____。
(3)火星四射的燃烧反应:_____。
(4)氧化汞在加热时发生的反应:_____。
(5)高锰酸钾在加热条件下制取氧气的反应:_____。
(6)氯酸钾和二氧化锰在加热条件下制取氧气的反应:_____。
(7)木炭燃烧的反应:_____。
(8)红磷燃烧的反应:_____。
上述反应中,属于化合反应的是_____(填序号,后同),属于分解反应的是_____。
【答案】S+O2![]() SO2 2H2O2
SO2 2H2O2![]() 2H2O+O2↑ 3Fe+2O2
2H2O+O2↑ 3Fe+2O2![]() Fe3O4 2HgO
Fe3O4 2HgO![]() 2Hg+O2↑ 2KMnO4
2Hg+O2↑ 2KMnO4![]() K2MnO4+MnO2+O2↑; 2KClO3
K2MnO4+MnO2+O2↑; 2KClO3![]() 2KCl+3O2↑ C+O2
2KCl+3O2↑ C+O2![]() CO2 4P+5O2
CO2 4P+5O2![]() 2P2O5 (1)(3)(7)(8) (2)(4)(5)(6)
2P2O5 (1)(3)(7)(8) (2)(4)(5)(6)
【解析】
(1)硫燃烧会放出刺激性气味的气体,方程式为:S+O2![]() SO2;属于化合反应;
SO2;属于化合反应;
(2)实验室利用二氧化锰和过氧化氢在常温下制取氧气,方程式为:2H2O2![]() 2H2O+O2↑,属于分解反应;
2H2O+O2↑,属于分解反应;
(3)铁丝在氧气中燃烧火星四射,方程式为:3Fe+2O2![]() Fe3O4,属于化合反应;
Fe3O4,属于化合反应;
(4)氧化汞加热分解成氧气和汞,方程式为:2HgO![]() 2Hg+O2↑,属于分解反应;
2Hg+O2↑,属于分解反应;
(5)高锰酸钾加热生成锰酸钾、二氧化锰和氧气,方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;分解反应;
K2MnO4+MnO2+O2↑;分解反应;
(6)氯酸钾在二氧化锰的催化下生成氧气和氯化钾,方程式为:2KClO3![]() 2KCl+3O2↑,属于分解反应;
2KCl+3O2↑,属于分解反应;
(7)木炭在氧气中燃烧生成二氧化碳,方程式为:C+O2![]() CO2,属于化合反应;
CO2,属于化合反应;
(8)磷和氧气生成五氧化二磷,方程式为:4P+5O2![]() 2P2O5,属于化合反应。
2P2O5,属于化合反应。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】银白色的金属钠是化学实验室中常见的药品,其化学性质十分活泼。某化学兴趣小组的同学,进行如下探究活动。
[查阅资料]
将一小块银白色的金属钠放置在空气中会发生下列变化:
钠![]() 钠的氧化物
钠的氧化物![]() 氢氧化钠溶液
氢氧化钠溶液![]() 白色固体
白色固体
[查阅资料]
A.钠的氧化物有氧化钠(Na2O)和过氧化钠(Na2O2),都能与水反应,反应化学方程式
如:Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
B.CaCl2溶液呈中性;碳酸钠溶液能与CaCl2溶液发生复分解反应;
C.碳酸钠溶液与盐酸反应方程式有:
Na2CO3 +HCl=NaHCO3 +NaCl(盐酸量不足)
Na2CO3+2HCl=2NaCl+H2O+CO2↑(盐酸量过量)
探究一:钠的氧化物是Na2O还是Na2O2 ?
(1)为检验常温下钠与氧气反应的产物,是Na2O还是Na2O2,完成实验方案:
选取试剂 | 实验现象 | 实验结论 |
__________ | __________ | 产物为Na2O |
探究二:白色固体是NaOH还是Na2CO3 ?
(2) 钠在空气中放置一段时间得到白色固体的成分
猜想1:Na2CO3 猜想2:NaOH 猜想3:Na2CO3和NaOH
[实验1] 取少量白色固体加水配成溶液,再滴入几滴稀盐酸,无气泡产生。
化学小组认为:据此现象,还不能得出猜想2成立。理由是________________。
[实验2] 化学小组进行如下实验
实验操作 | 实验现象 | 实验结论 |
①取少量白色固体配成溶液,加入足量______ | __________ | 猜想3成立 |
②过滤,取少量滤液滴入___________ | __________ |
【题目】煅烧石灰石(主要成分 CaCO3)生成生石灰(CaO)和二氧化碳。为了测定某石灰石中碳酸钙(CaCO3)的含量,现称取 24.0g 石灰石样品,进行四次高温煅烧、冷却,称量剩余固体的质量 (杂质不参加反应),记录实验数据如下:
操作 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量 | 21.6g | 19.2g | 15.2g | 15.2g |
试计算:
(1)完全反应后生成二氧化碳的质量为_____;
(2)求该石灰石样品中碳酸钙的质量_____。