题目内容
【题目】阅读下面科普短文(原文作者:许谦,有删改)
酸奶口感酸甜,营养丰富,是深受人们喜爱的一种乳制品。与普通牛奶比较,酸奶中的蛋白质和钙更易被人体消化吸收,是乳糖不耐症患者的良好食品。
通常的酸奶是将牛奶发酵而制成的。牛奶中主要含有蛋白质、乳糖和脂肪。在发酵过程中,乳酸菌把乳糖(C12H22O11)转化成乳酸(C3H6O3),使得牛奶的酸度升高。随着酸度增加,蛋白质分子互相连接,形成了一个巨大的“网络”,这个“蛋白质网络”把乳糖、水、脂肪颗粒都“网”在其中。所以,奶变“粘”、变“酸”了。

酸奶中含有大量活力较强的乳酸菌。乳酸菌可抑制某些腐败菌和病原菌的繁殖,从而维持人体内,尤其是肠道内正常的微生态平衡,促进食物的消化吸收。酸奶在储藏和配送过程中,乳酸菌的数量会因乳酸的过量积聚而明显减少,而酸奶的乳酸积聚又会影响到酸奶的酸度。有研究者选取某种市面常见的酸奶进行实验,数据如下表所示。
表某品牌酸奶酸度的变化
温度/℃ 时间/天酸度/°T | 4 | 28 | 37 |
0 | 67.7 | 67.7 | 67.7 |
2 | 73.9 | 77.1 | 79.2 |
4 | 76.4 | 82.7 | 86.3 |
6 | 85.5 | 92.2 | 98.9 |
8 | 90.2 | 98.7 | 113.2 |
1999年颁布的国标GB2746-1999中,对成品酸奶的酸度规定为“酸度不小于70°T”。按照一般人的接受程度,酸奶酸度不能超过100°T。
依据文章内容回答下列问题。
(1)乳酸是由乳糖转化生成的,请比较二者的化学式,分析它们的相同点和不同点。
相同点:_____。
不同点:_____。
(2)实验中所用酸奶若在37℃条件下储存,_____天后,酸度一定会超出一般人的接受程度。(填字母序号,下同)
A 2 B 4 C 5 D 8
(3)由表中实验数据可知,影响酸奶酸度的因素有_____。
(4)下列关于酸奶的说法正确的是_____。
A 酸奶适用于乳糖不耐症患者食用
B 酸奶放置时间越长,乳酸菌含量越高
C 酸奶中的乳酸菌对人类身体有害无益
D 酸奶变“粘”与蛋白质分子相互连接形成巨大“网络”有关
【答案】组成物质的元素种类相同(或原子种类相同) 元素的质量百分含量不同(或原子个数比不同) D 温度、时间(多答“乳酸菌”不扣分) AD
【解析】
(1)乳糖的化学式为C12H22O11,乳酸的化学式为(C3H6O3),由化学式可知,他们都是由碳、氢、氧三种元素组成,但是他们所含碳、氢、氧原子的个数不同,各元素的质量分数不同。
(2)1999年颁布的国标GB2746-1999中,对成品酸奶的酸度规定为“酸度不小于70°T”,由表可知,在37℃条件下,乳糖(C12H22O11)转化成乳酸(C3H6O3)需要8天才能超过100°T,故选D。
(3)由表可知, 影响酸奶酸度的因素有温度和时间。
(4)A、酸奶适用于乳糖不耐症患者食用,正确;
B、酸奶在储藏和配送过程中,乳酸菌的数量会因乳酸的过量积聚而明显减少,故错误;
C、乳酸菌可抑制某些腐败菌和病原菌的繁殖,从而维持人体内,尤其是肠道内正常的微生态平衡,促进食物的消化吸收,故C选项错误;
D、由题干可知,酸奶变“粘”与蛋白质分子相互连接形成巨大“网络”有关,故D选项正确。故选AD。

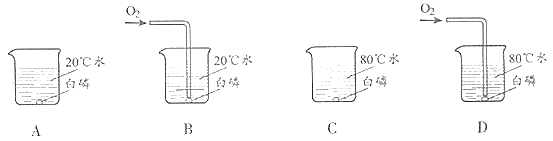
【题目】为探究CO2与NaOH溶液发生的反应,某兴趣小组尝试用不同的方式进行实验。
(查阅资料)
Ⅰ.20℃时,几种物质在水中的溶解度见下表:
物质 | Na2CO3 | NaHCO3 | Ca(OH)2 | Ba(OH)2 |
溶解度/g | 21.5 | 9.6 | 0.165 | 3.89 |
Ⅱ.本实验条件下,Na2CO3溶液和NaHCO3溶液的pH分别约为11.0和8.5。
(实验探究)
(1)实验一:小雨取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪,小雨另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是_________________________________,实验中,小雨采用两只矿泉水瓶做对比实验的目的是_________________________________。
(2)实验二:为检验CO2与NaOH溶液反应的产物,小亮取实验一所得溶液X少许,向其中滴加BaCl2溶液,有白色沉淀产生,该反应的化学方程式为_____________________________,实验中不宜将BaCl2溶液换成CaCl2溶液的原因是_____________________________________。
(3)实验三:小华取实验一所得溶液X少许,向其中加入过量的BaCl2溶液,振荡,静置,取上层清液,滴入1滴酚酞试液,发现溶液呈____色,证明溶液X中有NaOH剩余。实验中,小华没有直接向少量溶液X中滴入酚酞试液,理由是___________________________________。
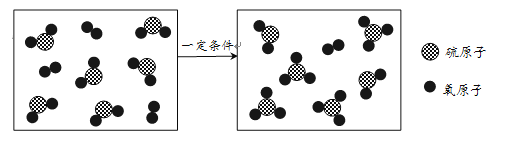
(4)实验四:兴趣小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中溶液的pH和温度变化,结果如图1、图2所示。
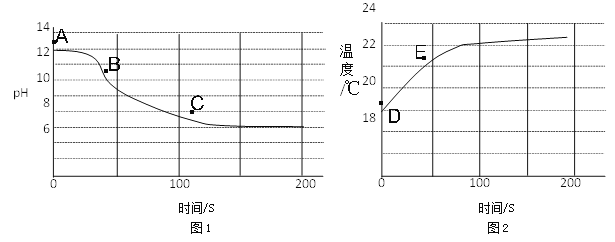
图1中,BC段发生反应的化学方程式为____________________________________。
图2中,DE段温度变化的原因是__________________________________________。
(反思感悟)
(5)实验从CO2减少、NaOH减少,Na2CO3生成等物质的变化,以及___________转化等视角多维度探究CO2与NaOH发生了反应,对于现象不明显的化学反应,可以通过现代技术手段进行数据测定,实现反应过程的“可视化”。
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。

(提出问题)从废旧手机中可以回收到哪些有价值的金属?如何回收?
(查阅资料)
i.手机电路板中的金属及其价格如下表所示:
种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
市场价格($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
ii.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;NiCl2溶液为绿色。
Iii.2Cu+O2+2H2![]() 2CuSO4+2H2O
2CuSO4+2H2O
(实验方案)
第一步:选择值得回收的金属。
依据资料i中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,原因是:①它们的市场价格较高;②_____。
第二步:设计实验分离、回收部分金属。
序号 | 实验步骤 | 实验现象 |
I | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
II | 将金属电路放入烧杯中,加入足量稀盐酸浸泡 | _____ |
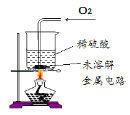
III | 取II中未溶解的金属电路,用蒸馏水洗净后,放入如图所示装置中,进行实验。
| 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
IV | 过滤III中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
V | _____ | 得到红色固体 |
(问题讨论)
(1)由步骤I中的现象,可推知的焊锡的物理性质是_____。
(2)步骤II对应的实验现象是_____。
(3)步骤II所得溶液中,一定含有的金属元素是_____。
(4)步骤V的操作是_____。
(反思交流)
为了确认步骤IV中滤纸上的金属成分,应进一步查阅的资料为_____。