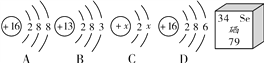��Ŀ����
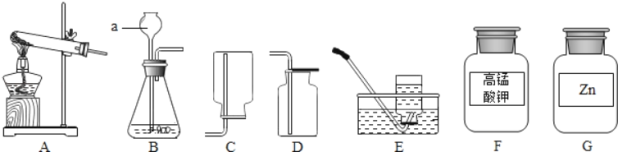
����Ŀ����ͼ��A��B��C��D��λͬѧ̽�������غ㶨�ɵ�ʵ��װ��ͼ��
A��B��C��D��λͬѧ���ֱ��������ȷ�IJ����������۲죮
��1��Aͬѧʵ�飺������ȼ����������ƿ�ŵ���ƽ�ϳ�������ƽ��ƽ�⣮�����ǣ��������غ㣮����Ϊ�ý����Ƿ���ȷ_____�������ȷ������ȷ��������ƽ��ƽ���ԭ����_____��
��2��Bͬѧ��ʵ���������ƽָ����_____������ҡ���ƫ���������Bͬѧ�Ľ�����װ�ã�д������ĸĽ����������ܻ�������̼���ƣ�_____��
��3��Cͬѧ��Ϊ����ʵ��˵���������غ㣮�����ԭ�ӵĽǶ�˵�������غ��ԭ��_____��
��4��Dͬѧ��ȡþ��������Ϊ10g��ʵ��������ȡʯ�����ϵ�����þ����ҲΪ10g��Dͬѧ��Ϊ�ɴ˿���˵�������غ㶨�ɳ���������ΪDͬѧ�Ĺ۵��Ƿ���ȷ��Ϊʲô��_____��
���𰸡�����ȷ ������ȼʱ��װ���������������ͽ������ʹ�װ���ܵ��ĸ������� �� ��Ϊ��ӦҪ�������壬���Ա������ܱյ����������з�Ӧ ��Ӧǰ��ԭ�ӵ���Ŀû��������ԭ�ӵ�����û�иı䣬ԭ�ӵ�����û�б仯 ����ȷ�����������غ㶨�ɲμӷ�Ӧ��þ�������Ͳμӷ�Ӧ������������֮�͵��ڷ�Ӧ���ɵ�����þ���������������ɵ�����þ������Ӧ����10g
��������
��1���ý��۲���ȷ����ƽ��ƽ���ԭ���ǰ�����ȼʱ��װ���������������ͽ������ʹ�װ���ܵ��ĸ�������
��2��Bʵ����������̼���Ʒ�Ӧ�������Ȼ��ơ�ˮ��������̼�����ɵĶ�����̼�ܵ��˿����У�ʹʣ�������������١�Bͬѧ��ʵ���������ƽָ������ƫ����Ӧʱ���������壬���Ա������ܱյ����������з�Ӧ��
��3�����������غ㶨�ɲμӻ�ѧ��Ӧ�ĸ����������ܺ͵��ڷ�Ӧ�����ɵĸ����������ܺͣ����Է�Ӧǰ��ԭ�ӵ���Ŀû��������ԭ�ӵ�����û�иı䣬ԭ�ӵ�����û�б仯��
��4�����������غ㶨�ɲμӻ�ѧ��Ӧ�ĸ����������ܺ͵��ڷ�Ӧ�����ɵĸ����������ܺͣ��μӷ�Ӧ��þ�������Ͳμӷ�Ӧ������������֮�͵��ڷ�Ӧ���ɵ�����þ���������������ɵ�����þ������Ӧ����10g���ʲ���ȷ��

 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�����Ŀ����ѧ��ȤС��̽������������ʱ����һ��ȥ������Ĥ��þ��������һ������ϡ�����У������ݲ�������ַ�Ӧ���ã������Թ����лҰ�ɫ������д���������ݵķ�Ӧ��ѧ����ʽ______��
��������⣩�Ұ�ɫ������ʲô���ʣ�
��������裩��С����Ϊ�Ұ�ɫ����Ϊ̼��þ��MgCO3��������ͬѧ��Ϊ����Ҫʵ����ܷ�С���IJ��룬������_____________________��
��С����Ϊ���ڷ�Ӧ���Ȼ�þ��������ƫ�࣬�Ұ�ɫ����Ϊ�������ܽ���Ȼ�þ���塣
��Сͮ��Ϊ�Ұ�ɫ����Ϊ__________________��
��ʵ��̽��1��
ʵ����� | ���� | ���� |
��ȡ�Թ��е��ϲ���Һ�������������Ȼ�þ���� | �Ȼ�þ����__��ѡ�����ܽ����������ܽ����� | С�������� |
��ȡ������ɫ������������ϡ������ | û������ð�� | Сͮ������� |
��������̽���������ԭ�в������˷�
���������ϣ�
HCl+AgNO3�THNO3+AgCl����AgCl��һ�ְ�ɫ�������Ȼ������������壬��ʹ��ɫʯ����ֽ��졣����
��ʵ��̽��2��
��������ȡ�Ұ�ɫ���������Թ��м��ȣ���պ����������Һ�IJ����������Թ��ڣ��������ϵ���Һ���ְ�ɫ���ǣ�֤��������__���塣��μ�����������_______��ʵ�鲽�衢�����ۣ���
ͬѧ�������ʦ���֪��������þ��ϡ���ᷴӦʱ����Һ�ᾭ�������Ե������Ҽ�������ǿ�Ĺ��̣��Ӷ������˼�ʽ�Ȼ�þ�������������ܣ���ʽ�Ȼ�þ���ڶ�����ɽṹ����ѧͨʽ�ɱ�ʾΪMgx��OH��yClzmH2O������2x��y��z=0��0��m��6����
����˼��չ��
��1����þ��ϡ���ᷴӦ��ʵ��ʱ��Ϊ�˲����Թ��г��ֻҰ�ɫ������þ��������_______��
��2����Ƭ��ͭƬ����ϡ�����в���������Ҳ����ͬ���ݴ��Ʋ�����Ļ�Ա�ͭ_____��