题目内容
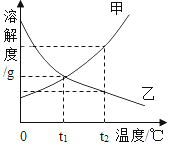
【题目】甲、乙两种固体的溶解度曲线如图所示。下列说法中正确的是( )
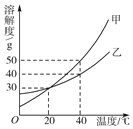
A. 40℃时,乙的溶解度大于甲
B. 20℃时,甲、乙两种溶液的溶质质量分数相等
C. 40℃等质量的甲、乙饱和溶液降温至20℃,甲析出晶体多
D. 20℃时,将40g甲、乙物质分别加入100g水中,加热到40℃时,甲溶液为饱和溶液
【答案】C
【解析】
A、由溶解度曲线可知,40℃时,甲的溶解度大于乙,此选项错误;
B、20℃时,甲、乙两种物质的溶解度相等,则20℃时,甲、乙两种物质的饱和溶液的溶质质量分数相等,该题中没有说明溶液是否饱和,此选项错误;
C、由溶解度曲线可知,甲的溶解度受温度影响比乙大,故40℃等质量的甲、乙饱和溶液降温至20℃,甲析出晶体多,此选项正确;
D、40℃时,甲的溶解度是50g,乙的溶解度是40g,故20℃时,将40g甲、乙物质分别加入100g水中,加热到40℃时,甲溶液为不饱和溶液,乙溶液恰好是饱和溶液,此选项错误。
故选C。

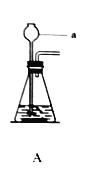
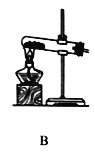
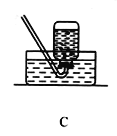
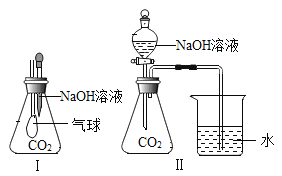
【题目】某校化学兴趣小组在探究“酸碱盐的相关性质”时,做了如图一所示的两个实验,实验结束后,小组同学将两支试管中的废液同时倒入一个洁净的烧杯中(如图所示),观察到有气泡产生,为确认烧杯内溶液中溶质的成分,同学们进行了如下探究。
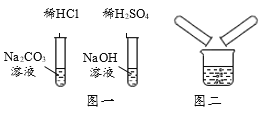
(查阅资料)Na2SO4溶液、NaCl溶液呈中性。
(提出猜想)猜想1:Na2SO4、NaCl;
猜想2:Na2SO4、NaCl和_____;
猜想3:Na2SO4、NaCl和H2SO4;
猜想4:Na2SO4、NaCl、H2SO4和Na2CO3。
(交流讨论)小强同学认为猜想4一定是错误的,他的理由是_____(用化学方程式表示)。
(进行实验)小明同学设计如下两个实验方案:
实验步骤 | 实验现象 | 实验结论 | |
方案一 | 取少量烧杯中的溶液于洁净的试管中,加入几滴紫色石蕊溶液 | _____ | 猜想3正确 |
方案二 | 取少量烧杯中的溶液于洁净的试管中,加入少量铁粉 | _____ |
请写出方案二中有关反应的化学方程式:_____。
(反思与总结)分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑反应物是否过量。