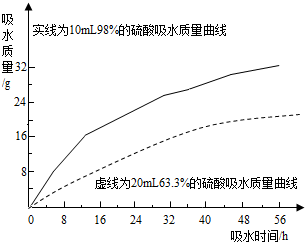
题目内容
(2012?泰州)下图是用绿色粉末A制取红色金属H的两种流程,其中白色固体F是一种常见的建筑材料,固体乙是目前用途最广、产量最高的金属.
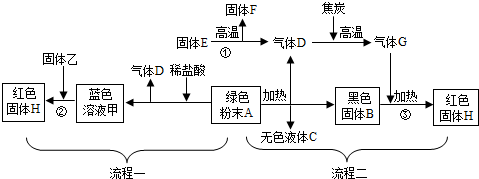
请回答下列问题:
(1)写出有关物质的化学式:B
(2)写出转化①的化学方程式
(3)转化②的过程中生成红色固体H的化学方程式为
(4)转化③发生的反应方程式为
(5)如果在实验室中由物质A制取H,上述两种流程中,操作比较简便的是流程

请回答下列问题:
(1)写出有关物质的化学式:B
CuO
CuO
;乙Fe
Fe
.(2)写出转化①的化学方程式
CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
,F的其他用途有
| ||
干燥剂或消毒剂等
干燥剂或消毒剂等
.(3)转化②的过程中生成红色固体H的化学方程式为
Fe+CuCl2═Cu+FeCl2
Fe+CuCl2═Cu+FeCl2
;如果在转化②中同时产生气体,则原因是(用化学方程式说明)Fe+2HCl═H2↑+FeCl2
Fe+2HCl═H2↑+FeCl2
.(4)转化③发生的反应方程式为
CO+CuO
Cu+CO2.
| ||
CO+CuO
Cu+CO2.
.
| ||
(5)如果在实验室中由物质A制取H,上述两种流程中,操作比较简便的是流程
一
一
.分析:根据题目给出的信息和流程图可知:绿色粉末A制取红色金属H,实际是碱式碳酸铜制取铜的过程;碱式碳酸铜在加热的条件下生成氧化铜和水和二氧化碳,因此黑色固体B是氧化铜;碳酸钙高温煅烧生成氧化钙和二氧化碳,因此E是碳酸钙,F是氧化钙,D是二氧化碳,氧化钙可以做干燥剂,也可以用来做消毒剂等;二氧化碳被碳还原得到一氧化碳,一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,因此G是一氧化碳,H是铜.碱式碳酸铜和盐酸反应生成氯化铜和水和二氧化碳,因此甲是氯化铜;固体乙是目前用途最广、产量最高的金属,因此乙是铁,铁与氯化铜反应生成铜和氯化亚铁.如果在实验室中由物质A制取H,操作一比较简便.
解答:解:(1)绿色粉末A制取红色金属H,实际是碱式碳酸铜制取铜的过程;碱式碳酸铜在加热的条件下生成氧化铜和水和二氧化碳,因此黑色固体B是氧化铜;固体乙是目前用途最广、产量最高的金属,因此乙是铁;故答案为:CuO、Fe;
(2)碳酸钙高温煅烧生成氧化钙和二氧化碳,因此E是碳酸钙,F是氧化钙,D是二氧化碳,氧化钙可以做干燥剂,也可以用来做消毒剂等;故答案为:CaCO3
CaO+CO2↑,干燥剂或消毒剂等(其它合理答案均可)
(3)铁与氯化铜反应生成铜和氯化亚铁,如果在转化②中同时产生气体,则说明盐酸过量,铁和盐酸反应生成氯化亚铁和氢气,配平即可;故答案为:Fe+CuCl2═Cu+FeCl2;Fe+2HCl═H2↑+FeCl2.
(4)一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,故答案为:CO+CuO
Cu+CO2.
(5)如果在实验室中由物质A制取H,操作一比较简便,故答案为:一.
(2)碳酸钙高温煅烧生成氧化钙和二氧化碳,因此E是碳酸钙,F是氧化钙,D是二氧化碳,氧化钙可以做干燥剂,也可以用来做消毒剂等;故答案为:CaCO3
| ||
(3)铁与氯化铜反应生成铜和氯化亚铁,如果在转化②中同时产生气体,则说明盐酸过量,铁和盐酸反应生成氯化亚铁和氢气,配平即可;故答案为:Fe+CuCl2═Cu+FeCl2;Fe+2HCl═H2↑+FeCl2.
(4)一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,故答案为:CO+CuO
| ||
(5)如果在实验室中由物质A制取H,操作一比较简便,故答案为:一.
点评:本考点考查了物质的制备和转化,物质的制备有一下几种类型:一种是只能用题目给出的原料来制取;一种是自己选取原料来制备新物质;还有的是给你一部分药品,其它自选等.本题要根据流程图,结合物质的性质,灵活应用,答案就会迎刃而解.本考点主要出现在填空题和实验题中.

练习册系列答案
相关题目