题目内容
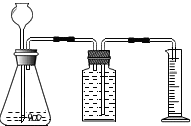 利用右图装置能制取氢气并测定所收集气体的体积.毛毛同学在锥形瓶中装入13g锌粒,往长颈漏斗中加入100g稀硫酸溶液,两者恰好完全反应.
利用右图装置能制取氢气并测定所收集气体的体积.毛毛同学在锥形瓶中装入13g锌粒,往长颈漏斗中加入100g稀硫酸溶液,两者恰好完全反应.(1)如图装置采用的是
(2)求稀硫酸中溶质的质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)图示装置表明,气体通过排出装置内的水而被收集,并通过量筒量取所排出水的体积测量收集氢气的体积,所以在选用量筒时应根据所要收集氢气体积而确定量筒量程;
(2)根据锌与硫酸反应的化学方程式,确定反应中消耗锌与硫酸的质量关系,利用这一质量关系可由恰好完全反应锌的质量计算出稀硫酸中所含硫酸的质量,从而求得所用稀硫酸中溶质的质量分数.
(2)根据锌与硫酸反应的化学方程式,确定反应中消耗锌与硫酸的质量关系,利用这一质量关系可由恰好完全反应锌的质量计算出稀硫酸中所含硫酸的质量,从而求得所用稀硫酸中溶质的质量分数.
解答:解;
(1)产生的氢气排出装置内的水,排出水的体积等于所收集到氢气的体积,因此收集300mL氢气需排出300mL水,则需要选用500mL的量筒进行测定;
(2)设稀硫酸中含溶质的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 98
13g x
=
x=19.6g
稀硫酸中溶质质量分数=
×100%=19.6%
答案:
(1)排水;500.
(2)稀硫酸中溶质质量分数为19.6%.
(1)产生的氢气排出装置内的水,排出水的体积等于所收集到氢气的体积,因此收集300mL氢气需排出300mL水,则需要选用500mL的量筒进行测定;
(2)设稀硫酸中含溶质的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 98
13g x
| 65 |
| 98 |
| 13g |
| x |
x=19.6g
稀硫酸中溶质质量分数=
| 19.6g |
| 100g |
答案:
(1)排水;500.
(2)稀硫酸中溶质质量分数为19.6%.
点评:在使用量筒量取液体体积时,选用量筒应遵循一次性原则即选用量筒的量程稍大于所要量取液体的体积而一次性测量,以保证测量的精确度.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
掌握化学用语是学好化学的关键,下列化学用语与含义相符的是( )
| A、Fe2O3--氧化铁 | ||
| B、2H--2个氢元素 | ||
| C、O2--2个氧原子 | ||
D、
|
 小刚同学为补充维生素,服用XX牌多维元素片,该片剂标签如图所示.请你计算:
小刚同学为补充维生素,服用XX牌多维元素片,该片剂标签如图所示.请你计算: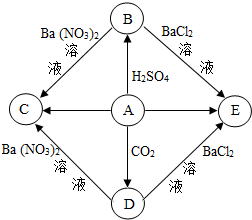 如图是A、B、C、D、E五种物质的转化关系,部分反应物、生成物及反应条件已省略.其中A是钠的氧化物,B、C、D、E是初中常见的钠盐.请回答:
如图是A、B、C、D、E五种物质的转化关系,部分反应物、生成物及反应条件已省略.其中A是钠的氧化物,B、C、D、E是初中常见的钠盐.请回答: