题目内容
某沿海工业区排放的污水中含有少量的Fe2+,Na+,Ca2+,Cu2+,Cl-,为了达到零污染的目标,将污水进行如下工业流程处理:
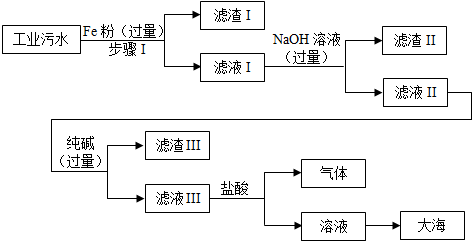
(1)步骤Ⅰ的操作名称是 ,并写出步骤Ⅰ中的化学方程式 .
(2)滤渣Ⅰ所含的物质是 (填化学式).
(3)加入过量NaOH溶液的目的是 .
(4)在滤液Ⅲ中加入盐酸使得到的溶液呈中性,要使用 来测定溶液的酸碱度,确保盐酸不过量.

(1)步骤Ⅰ的操作名称是
(2)滤渣Ⅰ所含的物质是
(3)加入过量NaOH溶液的目的是
(4)在滤液Ⅲ中加入盐酸使得到的溶液呈中性,要使用
考点:金属活动性顺序及其应用,过滤的原理、方法及其应用,书写化学方程式、文字表达式、电离方程式
专题:化学与环境保护
分析:(1)根据分离固体和液体的方法以及金属活动顺序来分析解答;
(2)根据金属活动性顺序以及铁粉过量来分析;
(3)根据氢氧化钠溶液能与氯化亚铁溶液反应来分析;
(4)根据测定溶液pH的方法来分析.
(2)根据金属活动性顺序以及铁粉过量来分析;
(3)根据氢氧化钠溶液能与氯化亚铁溶液反应来分析;
(4)根据测定溶液pH的方法来分析.
解答:解:(1)分离难溶性固体和液体应该采用过滤的方法;因为在金属活动顺序中,铁排在铜的前面,因此可以置换出氯化铜中的铜;故填:过滤;Fe+CuCl2=Cu+FeCl2;
(2)因为在步骤Ⅰ中加入的铁粉是过量的,所以滤渣Ⅰ是置换出来的铜与剩余的铁的混合物;故填:Fe和Cu;
(3)氢氧化钠溶液能与氯化亚铁溶液反应生成氯化钠和氢氧化亚铁沉淀,加入过量的氢氧化钠溶液就可以将亚铁离子完全除去;故填:完全除去Fe2+;
(4)测定溶液的酸碱度,也就是pH,通常用pH试纸.故填:pH试纸.
(2)因为在步骤Ⅰ中加入的铁粉是过量的,所以滤渣Ⅰ是置换出来的铜与剩余的铁的混合物;故填:Fe和Cu;
(3)氢氧化钠溶液能与氯化亚铁溶液反应生成氯化钠和氢氧化亚铁沉淀,加入过量的氢氧化钠溶液就可以将亚铁离子完全除去;故填:完全除去Fe2+;
(4)测定溶液的酸碱度,也就是pH,通常用pH试纸.故填:pH试纸.
点评:本题考查了金属活动性、化学方程式的书写、物质的分离等知识点,难度较大,注意会运用溶液的pH值对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
下列现象描述错误的是( )
| A、硫在氧气中燃烧发出蓝紫色火焰 |
| B、铁丝在氧气中剧烈燃烧,火星四射 |
| C、红磷在空气中燃烧放出大量烟雾 |
| D、木炭在空气中燃烧发出红光 |
 肥田粉是常用的氮肥,如图为某品牌肥田粉的部分标签.
肥田粉是常用的氮肥,如图为某品牌肥田粉的部分标签. 氯化钠是一种重要的盐,也是人生理活动必须的物质,根据所学知识回答:
氯化钠是一种重要的盐,也是人生理活动必须的物质,根据所学知识回答: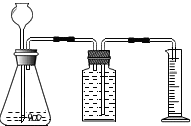 利用右图装置能制取氢气并测定所收集气体的体积.毛毛同学在锥形瓶中装入13g锌粒,往长颈漏斗中加入100g稀硫酸溶液,两者恰好完全反应.
利用右图装置能制取氢气并测定所收集气体的体积.毛毛同学在锥形瓶中装入13g锌粒,往长颈漏斗中加入100g稀硫酸溶液,两者恰好完全反应.