题目内容
【题目】下图为某化学兴趣小组探究金属的化学性质时所做的四个实验,仔细分析后回答下列问题:
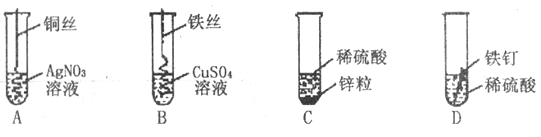
(1)描述A中的实验现象______________________________________;
(2)表示我国湿法冶铜原理的是___________________(填字母序号);
(3)写出C中反应的化学方程式___________________;
(4)要证明Cu、Fe、Ag的金属活动性顺序,至少要做的实验是___________________(填字母序号);
(5)要证明Zn、Fe、H、Cu、Ag的金属活动性(包括氢)由强到弱顺序,需要补充一个实验是______________________________________;
(6)开始反应后D中溶液逐渐变为黄色,原因是___________________。
【答案】 铜丝表面附着一层银灰色固体物质,溶液由无色变成蓝色 B Zn+H2SO4=ZnSO4+H2↑ AB 将铜放入稀硫酸中 铁钉表面的铁锈没有打磨或有硫酸铁生成
【解析】金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。铜和硝酸银反应生成硝酸铜和银,现象是铜丝表面附着一层银灰色固体物质,溶液由无色变成蓝色;湿法炼铜常用铁和硫酸铜反应;锌和硫酸反应生成硫酸锌和氢气,方程式为:Zn+H2SO4=ZnSO4+H2↑;要证明Cu、Fe、Ag的金属活动性顺序,至少要做的实验是铜和硝酸银反应,证明铜的活动性比银强;铁和硫酸铜反应,证明铁的活动性比铜强,所以三种金属的活动性顺序是:铁>铜>银;要证明Zn、Fe、H、Cu、Ag的金属活动性(包括氢)由强到弱顺序,需要补充一个实验是将铜放入稀硫酸中 铁和酸反应,说明铁在氢前,铜不与酸反应,说明铜在氢后;铁钉的表面是铁锈,主要成分是氧化铁,和硫酸反应生成硫酸铁,溶液中有铁离子,溶液为黄色。

【题目】粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙)。某实验小组的同学在粗盐提纯实验中,并把少量可溶性杂质CaCl2,MgCl2一并除去,设计如下实验方案,请回答问题:
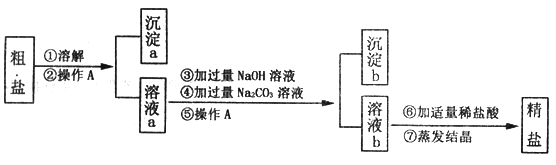
(1)实验操作A的名称是___________________;
(2)写出步骤③中发生反应的主要化学方程式_________________;沉淀b中含有物质____________(填化学式);
(3)实验中某同学对溶液b的成分进行了探究。
【提出问题】溶液b中除了含有水和氯化钠外,还含有哪些物质?
【提出猜想】根据实验①②③④⑤的操作后,作出如下猜想。
猜想一:还含有碳酸钠;
猜想二:还含有氢氧化钠;
猜想三:还含有碳酸钠和氢氧化钠。
【验证猜想】
步骤 | 实验操作 | 实验现象 | 推断 |
1 | 取少量溶液b于试管中,加入过量的氯化钙溶液,振荡,静置 | _______________ | 溶液b中还含有________溶质 |
2 | 取步骤1反应后的混合液过滤后,取滤液少量于试管中加入__________(填指示剂) | _______________ | 溶液b中还含有氢氧化钠 |
【实验结论】经过兴趣小组的实验分析,判断猜想___________是正确的。
【反思与拓展】为了使制得的精盐水只含有水和氯化钠,步骤⑥的作用是除去杂质,请写出其中一个反应的化学方程式:________________。


