题目内容
【题目】碳酸氢钠是小苏打的主要成分,在生产和生活中有许多重要的用途。化学课上,同学们为了解碳酸氢钠的性质,将一定质量的碳酸氢钠和稀硫酸混合,充分反应后,有气体逸出。同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外可能还含有其他成分,因此进行了猜想并做了如下实验:
(猜想与假设)反应后溶液中溶质的可能组成成分。
猜想一:硫酸钠;
猜想二:硫酸钠、碳酸氢钠;
猜想三:硫酸钠、______。
(实验探究)同学们取反应后的溶液用不同方案进行如下实验,请根据结论完成如表实验现象中的空格。
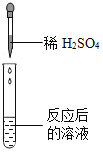
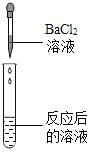
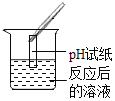
实验方案 | A | B | C |
实验操作 |
|
|
|
实验现象 | ______ | 产生白色沉淀 | 试纸变色,对照标准比色卡,pH ______ |
实验结论 | 猜想二不正确 | 猜想三正确 | 猜想三正确 |
(得出结论)猜想三正确。
(评价反思)
(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出三种探究实验中存在一处明显操作错误是:______![]() 填“A”、“B”、“C”
填“A”、“B”、“C”![]() 。
。
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由______。
(总结提高)
(3)除以上方案外,以下哪些物质单独使用,也能探究猜想三是正确的______![]() 填序号
填序号![]() 。
。
A锌粒 B无色酚酞 C氧化铜 D氢氧化钠
【答案】硫酸 不产生气泡 ![]() C 硫酸钠也能和氯化钡反应生成白色沉淀 AC
C 硫酸钠也能和氯化钡反应生成白色沉淀 AC
【解析】
[猜想与假设]
猜想一:恰好完全反应时溶质是硫酸钠。
猜想二:碳酸氢钠过量时溶质是硫酸钠、碳酸氢钠。
猜想三:硫酸过量时溶质是硫酸钠、硫酸。
[实验探究]
证明猜想二不正确,即证明溶液中不含碳酸氢钠,向反应后溶液中加入稀硫酸,根据实验结论:猜想二不成立,即溶液中不含碳酸氢钠,则实验现象是:不产生气泡;
由于猜想三正确,溶液中含有硫酸,硫酸溶液呈酸性,则溶液的pH<7;
[评价反思]
(1)探究中存在一处明显操作错误是:C。因为图中显示,实验时把pH试纸直接伸入了溶液中,而正确的操作是用玻璃棒蘸取溶液滴在pH试纸上。
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,因为硫酸和硫酸钠中都存在硫酸根离子,所以理由是:硫酸钠也能和氯化钡反应生成白色沉淀。
[总结提高]
A、锌粒与硫酸反应生成氢气,会有气泡冒出,锌不能与硫酸钠和碳酸氢钠反应,故可以验证硫酸的存在,选项A正确;
B、无色酚酞在酸性和中性时都不变色,不可以验证硫酸的存在,选项B错误;
C、氧化铜与硫酸反应生成蓝色的硫酸铜溶液,氧化铜不能与硫酸钠和碳酸氢钠反应,故可以验证硫酸的存在,选项C正确;
D、氢氧化钠与硫酸反应无现象,不可以验证硫酸的存在,选项D错误。故选AC。

【题目】某样品为铜和氧化铜的混合物,为测定样品中氧化铜的含量,甲、乙、丙、丁四位同学用同一样品分别进行实验,测定的实验数据如下表。请分析数据解答下列问题:
甲 | 乙 | 丙 | 丁 | |
所取固体样品的质量 | 25 | 25 | 20 | 20 |
加入硫酸溶液质量 | 50 | 100 | 100 | 120 |
反应剩余固体质量 | 21 | 17 | 12 | 12 |
(1)四位同学中, 同学所取的硫酸溶液质量不足(从“甲”、“乙”、“丙” 或“丁”中选择填写);
(2)混合物氧化铜的质量分数为?
(3)硫酸溶液中溶质的质量分数为?