题目内容
【题目】甲乙两化学兴趣小组的同学按课本上的实验装置做“测定空气中氧气的体积分数”实验(如图甲所示),但测出的氧气的体积分数存在误差。

请你参与探究:
甲组测出氧气的体积分数小于五分之一
(提出问题)造成误差的原因是什么?如何改进课本上的实验装置?
(查阅资料)红磷、白磷的一些性质如下表:
颜色、状态 | 熔点/℃ | 着火点/℃ | 密度(g/cm3) | |
红磷 | 暗红色固体 | 590 | 240 | 2.34 |
白磷 | 白色或黄色固体 | 44.1 | 40 | 1.82 |
(猜想与假设)
A同学:可能是导管内原含有空气,后来留有吸入的水,影响实验的准确性。
B同学:可能是瓶内残留气体中还有氧气。
(1)你还能作出的猜想是____________________________。
(交流与讨论)
他们对课本上的实验装置进行了图乙所示的改进(其他仪器忽略)。
(2)与课本上的实验装置相比较,该装置的一个优点是 _______________。
(3)能得出空气中氧气约占五分之一体积的实验现象是 _______________。
乙组同学从课本镁条燃烧实验得到启发,用镁代替红磷,实验完毕,冷却后进入水的体积远大于总容积的1/5。
(猜想与假设)可能镁条与氮气发生了反应
(设计实验)
为检验镁条能否在N2中燃烧,兴趣小组展开如下探究:

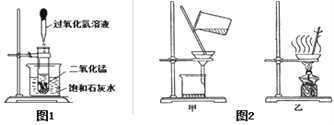
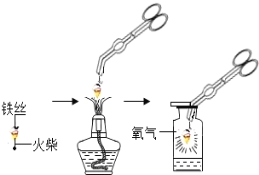
①组装仪器(图1,钟罩下端无底),检查气密性:向水槽中加水,观察现象;
②将足量白磷在空气中点燃后,迅速伸入钟罩内,塞紧橡皮塞;
③待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平;
④打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2),观察液面变化;
(交流讨论)
(4)步骤①气密性良好的现象是________________________;
(5)步骤②目的是_____________________________________;
(6)步骤④观察到_____________________现象,说明镁条与氮气反应。
(结论)除氧气外,镁条还能与氮气反应。
(反思)乙组小罗同学认为只进行图2实验,当钟罩内进入水的体积大于总容积的1/5,就能说明镁与氧气、氮气都发生了反应,对此观点你认为是否正确_______,并说明理由__________________ 。
(拓展)①镁与氮气反应生成氮化镁(Mg3N2),由于氧气比氮气活泼,所以镁燃烧生成的氮化镁质量比氧化镁_______(大、小)。
②8g镁在空气中燃烧,若有30%的镁生成氮化镁,计算氮化镁的质量__________(写出计算过程)。
【答案】红磷量不足/橡皮塞未塞紧(合理即可) 确保装置不漏气 左边液面上升至“1”刻度处 表面皿上浮 对比实验 图2中的表面皿高于图1中的表面皿 不正确 可能实验误差造成,如:装置的气密性不好,导致气体逸出等 小 3.3g
【解析】
[猜想与假设]
(1)测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使瓶内气体减少,压强变小,水倒流入集气瓶内,倒流的水的体积就等于瓶内氧气的体积。还可能作出的猜想是红磷量不足、橡皮塞未塞紧(即装置的气密性不好)或者没冷却到室温(合理即可)导致甲组测出氧气的体积分数小于五分之一;
[交流与讨论]
(2)与课本上的实验装置相比较,该装置的一个优点是确保装置不漏气(即能始终保持良好的气密性),使测定结果更准确;
(3)能得出空气中氧气约占五分之一体积的实验现象是左边液面上升至“1”刻度处;
[交流讨论]
(4)步骤①气密性良好的现象是表面皿上浮;
(5)步骤②目的是对照试验,通过比较表面皿上升的程度,探究镁条是否与氮气反应;
(6)步骤④观察到图2中的表面皿高于图1中的表面皿,说明镁条与氮气反应;
[反思]乙组小罗同学认为只进行图2实验,当钟罩内进入水的体积大于总容积的1/5,就能说明镁与氧气、氮气都发生了反应,此观点不正确,理由:可能实验误差造成,如:装置的气密性不好,导致气体逸出等;
[拓展]①镁与氮气反应生成氮化镁(Mg3N2),由于氧气比氮气活泼,所以镁燃烧时几乎都与氧气发生了反应,因此生成的氮化镁质量比氧化镁小;
②8g镁在空气中燃烧,若有30%的镁生成氮化镁,则氮化镁中镁元素的质量为8g×30%=2.4g,氮化镁的质量: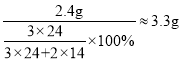 。
。