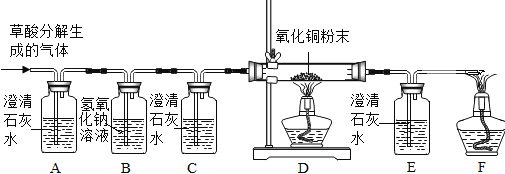
题目内容
【题目】自然界的水含有各种杂质,可以用不同的方法进行净化。

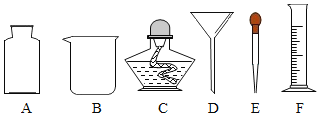
(1)如图所示是用空塑料饮料瓶、带导管的单孔胶塞、蓬松棉、纱布、活性炭、小卵石、石英沙等材料自制的一个简易净水器。
①根据上述净化材料的特性,B层放置的材料最好是____;
②该净水器第二层纱布的主要作用是________;
③你认为上述简易净水器(填“可以”或“不可以”)___将硬水变成软水,原因___;用___能区分硬水和软水。
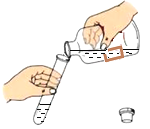
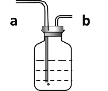
(2)如图为过滤装置,根据实验回答下列问题:
①写出标号仪器的名称:a______;
②实验过程中玻璃棒的作用是______;
③过滤后发现滤液仍然浑浊,可能的原因是(答出三点)____、_____、____
【答案】石英砂 阻挡石英砂进入A层 不可以 活性炭不能吸附可溶性钙离子、镁离子 肥皂水 铁架台 引流 滤纸破损 玻璃棒指向单层滤纸引流 液体液面高于滤纸边缘
【解析】
(1)过滤应由粗到细,小卵石过滤大颗粒杂质,石英砂过滤比较的颗粒杂质;防止石英砂进入到下一层,以免减弱活性炭的吸附作用;此净水器不可以将硬水软化,因为除杂物质中小卵石、石英砂以及活性炭都没有吸附可溶性离子的作用;肥皂水与硬水混合搅拌后,泡沫少,浮渣多,肥皂水与软水混合搅拌后,泡沫多,浮渣少;
(2)该仪器为铁架台;玻璃棒在过滤操作中主要是引流作用;1.滤纸破损2.玻璃棒指向单层滤纸一遍3.液体液面高于滤纸边缘

【题目】南南同学看到“好想你”红枣袋中装有一袋防腐剂,品名为“504双吸剂”,其标签如图1所示.南南和北北对这包久置的“504双吸剂”固体样品很好奇,设计如下实验进行探究.
(提出问题)久置固体的成分是什么?
(查阅资料)铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
(作出猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
(实验探究)
南南同学的方案:
实验操作 | 实验现象 | 实验结论 |
取少量固体放于试管中,滴加足量的_____. | 固体逐渐消失,有无色气体产生,得到浅绿色溶液. | 固体中一定含有_____, 一定不含Fe2O3. |
北北同学认为南南同学的实验并不能得出一定不含Fe2O3的结论,理由是_____,并设计如图2实验方案继续验证.
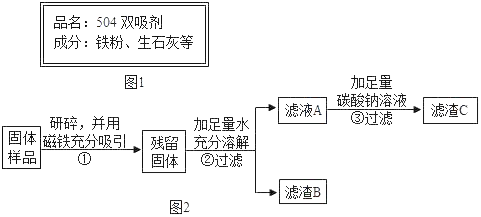
(1)步骤①样品用磁铁吸引前需经过研碎,其中研碎的目的是_____.
(2)步骤②中固体溶解时放出大量热,由此可以判断固体中一定含有_____.写出该过程中的化学方程式_____.
(3)步骤③中反应的化学方程式是_____.
北北同学对滤渣B又进行探究.
实验操作 | 实验现象 | 实验结论 |
①取滤渣B于试管中,加入适量 _____ ②生成的气体通入_____ | ①固体减少,_____ ②该溶液变浑浊. | 固体中一定含有CaCO3 和Fe2O3. |
(实验结论)综合上述实验及所给数据,该久置固体中一定含有的物质是Fe、Fe2O3、CaO、CaCO3.
(实验拓展)为增强双吸剂的吸收效果,常在双吸剂中加入一定量的NaCl,NaCl的作用可能是_____.
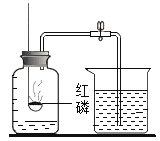
【题目】甲乙两化学兴趣小组的同学按课本上的实验装置做“测定空气中氧气的体积分数”实验(如图甲所示),但测出的氧气的体积分数存在误差。

请你参与探究:
甲组测出氧气的体积分数小于五分之一
(提出问题)造成误差的原因是什么?如何改进课本上的实验装置?
(查阅资料)红磷、白磷的一些性质如下表:
颜色、状态 | 熔点/℃ | 着火点/℃ | 密度(g/cm3) | |
红磷 | 暗红色固体 | 590 | 240 | 2.34 |
白磷 | 白色或黄色固体 | 44.1 | 40 | 1.82 |
(猜想与假设)
A同学:可能是导管内原含有空气,后来留有吸入的水,影响实验的准确性。
B同学:可能是瓶内残留气体中还有氧气。
(1)你还能作出的猜想是____________________________。
(交流与讨论)
他们对课本上的实验装置进行了图乙所示的改进(其他仪器忽略)。
(2)与课本上的实验装置相比较,该装置的一个优点是 _______________。
(3)能得出空气中氧气约占五分之一体积的实验现象是 _______________。
乙组同学从课本镁条燃烧实验得到启发,用镁代替红磷,实验完毕,冷却后进入水的体积远大于总容积的1/5。
(猜想与假设)可能镁条与氮气发生了反应
(设计实验)
为检验镁条能否在N2中燃烧,兴趣小组展开如下探究:

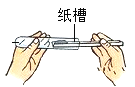
①组装仪器(图1,钟罩下端无底),检查气密性:向水槽中加水,观察现象;
②将足量白磷在空气中点燃后,迅速伸入钟罩内,塞紧橡皮塞;
③待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平;
④打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2),观察液面变化;
(交流讨论)
(4)步骤①气密性良好的现象是________________________;
(5)步骤②目的是_____________________________________;
(6)步骤④观察到_____________________现象,说明镁条与氮气反应。
(结论)除氧气外,镁条还能与氮气反应。
(反思)乙组小罗同学认为只进行图2实验,当钟罩内进入水的体积大于总容积的1/5,就能说明镁与氧气、氮气都发生了反应,对此观点你认为是否正确_______,并说明理由__________________ 。
(拓展)①镁与氮气反应生成氮化镁(Mg3N2),由于氧气比氮气活泼,所以镁燃烧生成的氮化镁质量比氧化镁_______(大、小)。
②8g镁在空气中燃烧,若有30%的镁生成氮化镁,计算氮化镁的质量__________(写出计算过程)。