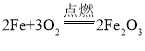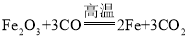题目内容
【题目】(1)请根据化学方程式计算:24g镁在氧气中完全燃烧,生成氧化镁的质量______。
(2)镁的化学性质非常活泼,可以和氮气反应生成氮化镁。已知氮元素的质子数为7,请画出氮原子的结构示意图______,由此推出氮元素的化合价为______。氮化镁与水反应生成氢氧化镁和氨气,请写出这一反应的化学方程式______。
(3)已知氮化镁是一种黄绿色的固体。根据镁在空气中燃烧的实验现象,可知在这样的条件下,镁更易与空气中的______化合。
(4)若有24g镁在空气中完全燃烧,则所得产物的总质量______(填“>、<、=”)40g
【答案】40g  -3价 Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ 氧气 <
-3价 Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ 氧气 <
【解析】
解:(1)设生成氧化镁的质量为x。

答:生成氧化镁的质量为40g。
(2)已知氮元素的质子数为7,核外电子数也是7,氮原子的结构示意图为: ;最外层有5个电子容易得到3个电子形成稳定结构,故氮元素的化合价为-3价;氮化镁与水反应生成氢氧化镁和氨气,化学方程式为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;
;最外层有5个电子容易得到3个电子形成稳定结构,故氮元素的化合价为-3价;氮化镁与水反应生成氢氧化镁和氨气,化学方程式为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;
(3)已知氮化镁是一种黄绿色的固体,但是镁在空气中燃烧的实验现象却是发出耀眼白光生成的白色固体,可知在这样的条件下,镁更易与空气中的氧气化合;
(4)当24g镁在空气中完全反应生成的物质都是氧化镁时,生成氧化镁的质量为40g;
当24g镁在空气中完全反应生成的物质都是氮化镁时,设生成氮化镁的质量是y。

24g镁在空气中完全燃烧会生成氧化镁和氮化镁,质量会介于33.3g—40g之间。故所得产物的总质量小于40g。

 阅读快车系列答案
阅读快车系列答案【题目】某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2)。该小组同学对该气体的成分进行如下探究:
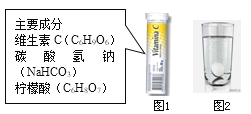
(猜想与假设)小华说:该气体可能是CO2、O2、CO、H2、N2。
(1)小明说:不可能含有N2,因为_____。
(2)小芳说:不可能含有CO和H2,因为从药品安全角度考虑,H2易燃易爆,CO_____。该小组同学认为:该气体可能含有CO2、O2中的一种或两种。
(进行实验)
实验编号 | 实验操作 | 实验现象 |
① | 将气体通入澄清的石灰水中 | 澄清石灰水变浑浊 |
② | 将带火星的木条伸入该气体中 | 带火星的木条没有复燃 |
(得出结论)(3)由实验①可知,该气体中肯定含有_____,写出该反应的化学方程式_____。
(4)由实验②_____(填“能”或“不能”)确定该气体中不含氧气,理由是_____。
【题目】某学习小组对在实验中吸收过二氧化碳气体的碱石灰成分进行了研究。
(查阅资料)
(1)碱石灰是CaO与NaOH的固体混合物,通常用于吸收二氧化碳及干燥气体。
(2)碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应。
(提出猜想)
该碱石灰的主要成分可能含有______、Ca(OH)2、CaCO3、NaOH和______。
(设计方案、收集证据)
(1)甲同学在烧杯中放入少量的碱石灰样品,加入足量蒸馏水,______(填操作名称)。使其充分溶解,静置有白色沉淀,甲同学认为原样品中一定含有CaCO3,乙同学认为他的结论不准确,原因是______(填化学方程式):
(2)乙同学进一步设计实验并进行验证,过程如下:
实验操作 | 实验现象 | 实验结论 |
①从甲同学的烧杯中取少量上层清液于试管中,向其中滴加足量 ______溶液。 | 有白色沉淀生成 | 生成白色沉淀的化学方程式_________ |
②过滤,向滤液中滴加无色酚酞试液 | 无明显现象 | 样品中不含 ______ |
(解释与评价)
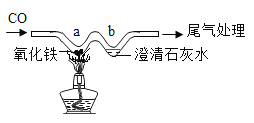
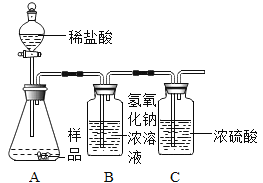
(1)乙同学进一步设计了如图实验装置,通过称量B装置的稀盐酸质量变化来确定样品的成分及质量(气密性良好,每步均完全反应,操作无误)。多次实验发现测定结果有时偏大有时偏小偏差,试分析其主要原因:______。
(2)在老师的指导下,乙同学完善了实验装置,并重新进行了实验,步骤如下:
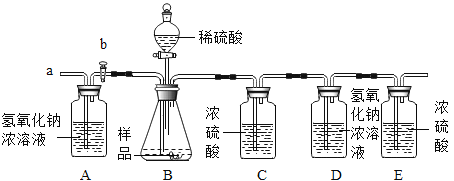
①检查装置的气密性,将5.06g干燥的样品放入锥形瓶中;
②向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④称量盛有氢氧化钠浓溶液的D瓶质量;
⑤再次打开活塞b,从导管a处缓缓鼓入一定量的空气;
⑥再次称量D瓶质量,增重2.2g。
实验操作顺序为:______(用上述序号表示)。步骤⑤的作用是:______。通过分析及计算可知:5.06g样品中各成分及质量______。