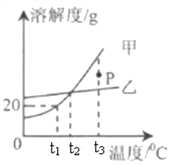
题目内容
【题目】小英、小明在学完酸的化学性质后,做了如下图1的①--⑤个实验,

据图1回答下列问题:
(1)反应后试管②③中一定含有的阳离子分别是_______、_______(填离子符号)。
(2)实验④在反应时没有明显的实验现象。如何才能确定实验④反应的发生_______。
(3)写出实验⑤发生反应的化学方程式__________。从粒子的角度分析,此化学反应能发生的原因 _________。实验结束后,小英依次将试管④⑤的废液缓缓倒入同一洁净的废液缸中(如上图2),观察到废液缸先有气泡产生,后有白色沉淀生成。通过废液缸中出现现象,经过讨论确定,试管④⑤中废液含有的溶质分别是:试管④ ___________ 、试管⑤________________。
(4)小英将废液缸中物质进行过滤,得到白色沉淀和无色滤液。欲探究无色滤液中溶质的成分。小英分析得出无色滤液中一定不含HCl,理由是 _____________________。
(提出问题)过滤出的无色滤液中含有什么溶质?
(作出猜想) ①NaCl; ②NaCl和CaCl2; ③NaCl 、CaCl2和Na2CO3; ④NaCl和Na2CO3。小明认为猜想_________一定不正确。
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
小英取少量滤液于试管中,滴加少量碳酸钠溶液 | 无明显现象 | 猜想2不成立 |
小英取少量滤液于试管中,滴加少量_____溶液 | 有沉淀生成 | 猜想______ 成立 |
(表达与交流)两位同学确认了最终废液中溶质的成分。你认为处理该废液的方法是________。
【答案】 Fe2+ Fe3+ 先向Ca(OH)2溶液中滴加几滴酚酞,溶液变红,再滴加稀盐酸 Na2CO3+2HCl =2 NaCl+ H2O+CO2↑ H+、CO32-结合生成水和CO2 CaCl2 HCl NaCl Na2CO3 因为白色沉淀是碳酸钙,如果有盐酸,它们会起反应 ③ 氯化钙 ④ 向最终废液中加入氯化钙溶液(或加入酸溶液)至中性后再倒掉废液
【解析】(1)反应后试管②中铁与盐酸反应生成氯化亚铁,所以溶液中一定含有Fe2+;③中氧化铁与盐酸反应生成氯化铁,所以溶液中一定含有Fe3+;
(2)盐酸与氢氧化钙反应生成氯化钙和水,恰好反应溶液变为中性,所以可以先向Ca(OH)2溶液中滴加几滴酚酞,溶液变红,再滴加稀盐酸,溶液逐渐变为无色,说明盐酸与氢氧化钙发生了反应
(3)写出实验⑤碳酸钠与盐酸发生反应生成氯化钠、水和二氧化碳,化学方程式为Na2CO3+2HCl =2 NaCl+ H2O+CO2↑;实质是H+、CO32-结合生成水和CO2;废液缸中先有气泡产生,然后又出现了白色沉淀,通过反应可知:盐酸和氢氧化钙溶液生成氯化钙和水,盐酸和碳酸钠生成氯化钠和水和二氧化碳;另外还应考虑盐酸和碳酸钠过量;所以知试管④含有CaCl2、HCl;试管⑤中含有NaCl、Na2CO3;
(4)混合后,先有气泡产生,后有白色沉淀生成,说明碳酸盐过量,盐酸被消耗完,得出无色滤液中一定不含HCl,
【作出猜想】乙同学认为猜想③NaCl、CaCl2和Na2CO3一定不正确,理由是:CaCl2和Na2CO3不能共存;
【进行实验】①取少量滤液于试管中,滴加少量碳酸钠溶液,无明显现象,说明一定没有氯化钙;②取少量滤液于试管中,滴加少量稀盐酸,有气泡产生,猜想④成立;
【表达与交流】废液中溶质的成分为NaCl和Na2CO3。碳酸钠溶液显碱性,所以向最终废液中加入氯化钙溶液(或加入酸溶液)至中性后再倒掉废液。

【题目】生活中常有误食亚硝酸钠(NaNO2)中毒事件的报道,这是因为亚硝酸钠外观酷似食盐且有咸味;工业用盐中常混有亚硝酸钠的,有关氯化钠和亚硝酸钠的部分资料如下:
化学式 | 颜色状态 | 酸碱性 | 加热 | 滴加稀盐酸 | 滴加硝酸银溶液 |
NaCl | 白色固体 | 中性 | 受热不分解 | 无明显变化 | 生成白色沉淀 |
NaNO2 | 白色固体 | 弱碱性 | 320℃以上分解生成刺激性气味的气体 | 生成红棕色气体 | 无明显变化 |
(1)用化学用语填空
标出亚硝酸钠中氮元素的化合价_______;硝酸银溶液中存在的离子有__________。
(2)从NaCl可以得出的信息有___________________________________(写1条)
(3)根据上表中资料,鉴别这两种白色固体的方法共有__________种。
(4)任选一种鉴别氯化钠和亚硝酸钠,写出实验的方案________________________________。
【题目】电池是日常必备用品之一,但它也是环境污染的一个重要来源。下面是某兴趣小组利用废旧锌锰干电池作为原料,并进行相关探究的过程。
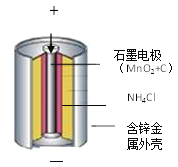
(知识储备)(1)锌锰电池的构造和组成(见图)。
(2)结晶水合物的特殊性质:在逐步升高温度条件下,结晶水合物能失去部分或者全部结晶水,如蓝色的胆矾晶体(CuSO4 5H2O)受热时可失去结晶水变为白色的无水硫酸铜粉末(CuSO4)。
I.制备皓矾晶体(ZnSO4xH2O)
小组同学参观了某回收废旧锌锰电池的工厂,其回收工艺流程如图:

⑴流程图中试剂a的化学式是__________;得到的滤液1农业上可用作_____________。
(2)将滤渣B在空气中充分灼烧 可提纯制得的固体是___________,该方法提纯的原理是(用化学方程式回答)____________________________。
⑶将滤液2中溶质主要是硫酸锌,其有关溶解度和温度关系如下表,
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
将滤液2蒸发浓缩、__________,可得到皓矾晶体(ZnSO4xH2O)。
II.皓矾晶体中结晶水含量的测定
小组同学将部分皓矾晶体(ZnSO4xH2O)带回实验室,用下图装置测定晶体中结晶水的含量(图中半透膜可让气体通过又可防止固体粉末进入导管)。
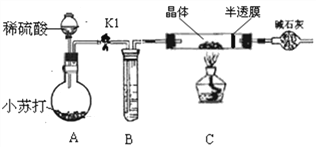
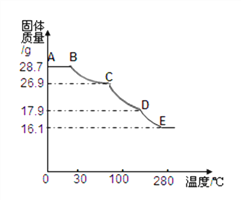
测定方法:称取28.7g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水:(ZnSO4xH2O == ZnSO4 + xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。
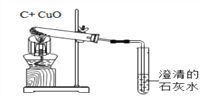
⑷A中的化学方程式是_____________,B中的试剂可从下列物质中选取,你的选择是__________________。
A.浓硫酸 B.硝酸银溶液 C.饱和碳酸钠溶液 D.澄清石灰水
⑸实验过程中若不通入CO2测得的结果将________(填“偏大”、 “偏小”或“无影响”)。
根据实验结果,计算皓矾晶体中结晶水的x值。计算过程:__________________
⑹将上述皓矾晶体加热会逐渐失去部分结晶水,加热过程中有关残留固体质量如下图,写出D-E段发生反应的化学方程式________________